
| A. | 同位素:1H、D+、T2 | |
| B. | 电解质:CaCO3、CH3COOH、NH4HCO3 | |
| C. | 胶体:饱和氯化铁溶液、淀粉溶液、牛奶 | |
| D. | 硅酸盐产品:晶体硅、水泥、陶瓷 |
分析 A.同位素是具有相同质子数不同中子数的一类原子;
B.电解质是在水溶液或熔融状态下能导电的化合物;
C.分散质粒子直径在1nm~100nm之间的分散系属于胶体;
D.三大硅酸盐产品水泥、玻璃、陶瓷.
解答 解:A.根据同位素的概念,同位素是具有相同质子数不同中子数的一类原子,本题中2H2为分子,故A错误;
B.电解质是在水溶液或熔融状态下能导电的化合物,CaCO3、CH3COOH、NH4HCO3分别是盐、酸和盐,均是电解质,故B正确;
C.氯化铁溶液不是胶体,故C错误;
D.晶体硅是硅单质,不是硅酸盐,故D错误.
故选B.
点评 本题考查同位素、电解质、胶体和硅酸盐产品等概念,题目较为简单,学习中注意对概念的理解要准确.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,实验中,可以观察到反应②的现象是:气体由无色变红棕色.
,实验中,可以观察到反应②的现象是:气体由无色变红棕色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Mg2+ I- SO32- | B. | Mg2+ Na+ CO32- I- | ||
| C. | Al3+Na+ SO32- I- | D. | Na+ CO32- Br-I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
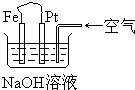
| A. | 这是电解NaOH溶液的装置 | |
| B. | 这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色 | |
| C. | Pt为正极,其电极反应为:O2+2H2O+4e-═4OH- | |
| D. | Fe为阳极,其电极反应为:Fe-2e-+2OH-═2Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止试管破裂,加热固体碳酸氢钠时,试管口应略向下倾斜 | |
| B. | 为防止液体暴沸,蒸馏时可在烧瓶中加入少量碎瓷片 | |
| C. | 容量瓶可用于配制一定物质的量浓度的溶液,不可作为反应容器使用 | |
| D. | 配制500mL 0.1 mol/L NaOH溶液时,将2g NaOH固体倒入500mL容量瓶中,加水至凹液面与刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com