
| A. | 5.6g铁粉与7.1g Cl2充分反应,转移电子数0.3NA | |
| B. | 1.7g羟基与1.6g甲烷分子所含电子数分别是0.9NA和NA | |
| C. | 3mol NO2与水充分反应时转移电子数2NA | |
| D. | 87g MnO2与含4NA HCl的浓盐酸加热反应,生成的氯气在标准状况下体积小于22.4L |
分析 A.铁与氯气反应生成氯化铁;
B.1个羟基含9个电子,1个甲烷分子含10个电子;
C.二氧化氮与水反应的化学方程式为:3NO2+H2O=2HNO3+NO,根据反应方程式,3molNO2与水充分反应时转移电子数;
D.稀盐酸与二氧化锰不反应.
解答 解:A.5.6g(0.1mol)铁粉与7.1g(0.1mol)Cl2充分反应,氯气的量不足,转移电子数小于0.3NA,故A错误;
B.1.7g(0.1mol)羟基含有电子0.9NA,1.6g(0.1mol)甲烷分子含电子数NA,故B正确;
C.二氧化氮与水反应的化学方程式为:3NO2+H2O=2HNO3+NO,根据反应方程式,3molNO2与水充分反应时转移电子数,故C正确;
D.随反应的进行,盐酸浓度减小,变成稀盐酸时不能与二氧化锰继续反应,所以生成的氯气在标准状况下体积小于22.4L,故D正确;
故选:A.
点评 本题考查了阿伏加德罗常数的相关计算,明确物质的结构和组成,掌握以物质的量为核心的计算公式是解题关键,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 使用高效低毒的农药,既能提高作物产量,又能降低农药残留量 | |
| B. | 食品包装袋中常放入生石灰作为抗氧化剂,防止食品变质 | |
| C. | 水瓶胆中的水垢可用饱和食盐水清洗 | |
| D. | 明矾可用于净水,也可用于淡化海水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHC03水溶液显碱性,溶液中阳离子电荷总数小于阴离子电荷总数 | |
| B. | SiO2不跟碱反应,但可与氢氟酸反应 | |
| C. | NO2难液化,易溶于水并跟水反应 | |
| D. | Fe3O4能与浓盐酸反应生成FeCl2和FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60、D2O、SiO2都属于化合物 | |
| B. | 漂白粉、石英、Fe(OH)3胶体都属于纯净物 | |
| C. | BaSO4、NH4Cl、NaOH都属于强电解质 | |
| D. | CO2、SO3、NO 都属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀硫酸中加入少量氢氧化钠固体,溶液导电性增强 | |
| B. | 饱和碳酸钠溶液中:c(Na+)=2c(CO32-) | |
| C. | 饱和食盐水中:c(Na+)+c(OH-)=c(Cl-)+c(H+) | |
| D. | pH=12的NaOH溶液中:c(OH-)=1.0×10-2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三月考二化学试卷(解析版) 题型:实验题
高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下:

查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定。
②在水中溶解度很大,难溶于无水乙醇等有机溶剂。
回答下列问题:
(1)写出氧化I中,生成Fe3+的离子反应方程式:
(2)氧化II中,试剂A为 (填“H2O2”或“HNO3”或“NaC1O”),反应的离子方程式为_____________________。
(3)操作I中包括冷却结晶,过滤洗涤、干燥几个步骤,洗涤干燥的目的是脱碱脱水,进行洗涤操作时应该用 洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式的系数及产物:
______K2FeO4 + H2O  Fe(OH)3(胶体)+ KOH + 。
Fe(OH)3(胶体)+ KOH + 。
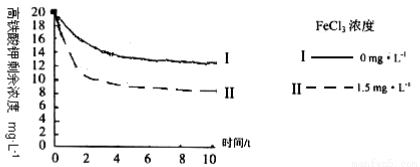
将一定量的K2FeO4投入一定浓度的FeC13溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是: 。
(5)制得的粗K2FeO4产品中常混有少量KCl。取5.0 g粗产品溶于足量稀硝酸,充分反应后,加入足量的硝酸银,过滤得到沉淀,洗涤、干燥,称量得到1.435 g固体,K2FeO4的质量分数为___________。(可能用到的相对原子质量:O 16 Cl 35.5 K 39 Fe 56 Ag 108)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物理量 实验序号 | V(溶液)/mL | NH4Cl质量/g | 温度/℃ | pH | … |
| 1 | 250 | m | T1 | X | … |
| 2 | 250 | m | T2 | Y | … |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com