
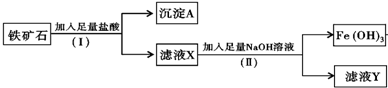
分析 加入盐酸,二氧化硅与盐酸不反应,则A为SiO2,X为FeCl3,加入足量氢氧化钠生成氢氧化铁,滤液Y含有Na+、Cl-,
(1)分离不溶物与溶液的操作方法为过滤;
(2)氧化铁与盐酸反应,二氧化硅不溶于盐酸,过滤后得到的沉淀A的主要成分为二氧化硅;二氧化硅能够与强碱反应生成盐和水;
(3)氧化铁与盐酸反应生成氯化铁和水;
(4)铁矿石与足量盐酸反应得到滤液X,X的主要成分是氯化铁和盐酸,滤液X与过量氢氧化钠反应,得到滤液Y,故Y的主要成分是氯化钠和氢氧化钠.
解答 解:加入盐酸,二氧化硅与盐酸不反应,则A为SiO2,X为FeCl3,加入足量氢氧化钠生成氢氧化铁,滤液Y含有Na+、Cl-,
(1)铁矿石的主要成分为Fe203和Si02,加入足量盐酸后,氧化铁与盐酸反应生成氯化铁和水,二氧化硅为难溶物且不与盐酸反应,可以通过过滤的方法分离,
故答案为:过滤;
(2)二氧化硅不与盐酸反应,所以过滤后得到的沉淀A的主要成分为SiO2;二氧化硅能够与强碱溶液反应生成盐和水,故二氧化硅属于酸性氧化物,
故答案为:SiO2;酸性;
(3)氧化铁与盐酸反应生成氯化铁和水,方程式为Fe2O3+6HCl=2FeCl3+3H2O,故答案为:Fe2O3+6HCl=2FeCl3+3H2O;
(4)铁矿石与足量盐酸反应得到滤液X,X的主要成分是氯化铁和盐酸,滤液X与过量氢氧化钠反应,得到滤液Y,故Y的主要成分是氯化钠和氢氧化钠,主要含有Na+、Cl-,
故答案为:Na+、Cl-.
点评 本题考查物质的分离、提纯实验,主要涉及了铁的氧化物、氢氧化物的性质、铁离子的检验方法、酸性氧化物的概念等知识,试题有利于培养学生的分析、理解能力.


科目:高中化学 来源: 题型:选择题
| A. | 实验室制取Cl2时,可用饱和Na2CO3溶液除去其中的HCl | |
| B. | 新制氯水需放在棕色试剂瓶中 | |
| C. | 漂白粉漂白时,向溶液中滴入少量的盐酸,漂白效果会增强 | |
| D. | 向石蕊溶液中通入氯气,溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 经常用钢丝球擦洗铝锅表面,可以防止铝锅被腐蚀 | |
| B. | 埋在地下的钢铁管道每隔一段距离就连结一定数量的铜块 | |
| C. | 供应热水的水龙头使用陶瓷制品代替钢铁制品 | |
| D. | 洗衣机的滚筒采用不锈钢材料,既耐磨又耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .元素D在元素周期表中的位置是第三周期VIIA族.
.元素D在元素周期表中的位置是第三周期VIIA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$ 2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$ 2SO3(g)反应过程的能量变化如图所示.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com