
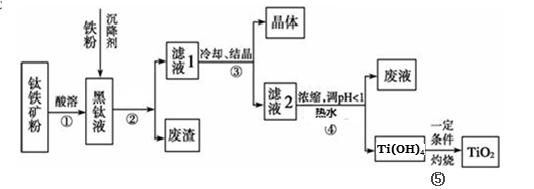
 Ti(OH)4 + 2H+,当加入热水稀释、升温后,
Ti(OH)4 + 2H+,当加入热水稀释、升温后, Ti(OH)4 + 2H+,水解反应是吸热反应,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4。
Ti(OH)4 + 2H+,水解反应是吸热反应,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源:不详 题型:单选题
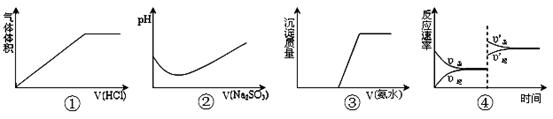
| A.①表示Na2CO3溶液中滴入稀盐酸 |
| B.②表示溴水中滴入Na2SO3溶液 |
| C.③表示HCl和MgCl2溶液中滴入氨水 |
D.④表示一定条件下反应:2SO2+O2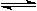 2SO3 ΔH< 0 ,达平衡后,增大压强 2SO3 ΔH< 0 ,达平衡后,增大压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CuS(s)+Mn2+(aq),下列说法错误的是 ( )
CuS(s)+Mn2+(aq),下列说法错误的是 ( )| A.相同条件下,MnS的Ksp比CuS的Ksp大 |
B.该反应的平衡常数K=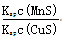 |
| C.该反应达到平衡时c(Mn2+)=c(Cu2+) |
| D.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。| | 甲 | 乙 | 丙 | |
| 起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
| n(O2) / mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
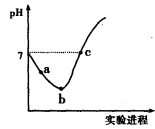
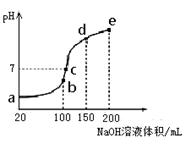
| A.实验进程中可用pH试纸测定溶液的pH |
B.c点所示溶液中: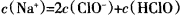 |
| C.向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 |
D.由a点到b点的过程中,溶液中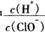 减小 减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
 2CO(g)+2H2(g) 的△H= ;
2CO(g)+2H2(g) 的△H= ;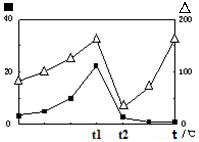 (?代表CO的生成速率,■代表催化剂的催化效率)
(?代表CO的生成速率,■代表催化剂的催化效率)查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是 ( )
2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是 ( )| A.40 mol 35% | B.20 mol 30% |
| C.20 mol 70% | D.10 mol 50% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com