
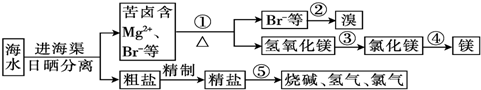
分析 海水暴晒然后分离得到粗盐和含有镁离子、溴离子的苦卤,向苦卤溶液中加入生石灰,发生反应CaO+H2O=Ca(OH)2、Mg2++2OH-=Mg(OH)2↓,向含有溴离子的溶液中加入氯水,发生反应2Br-+Cl2=2Cl-+Br2,然后萃取得到Br2,将Mg(OH)2溶于稀盐酸得到MgCl2,电解熔融氯化镁得到Mg,MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,提纯粗盐得到精盐,电解饱和食盐水得到烧碱、氯气和氢气,反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,据此分析解答.
解答 解:海水暴晒然后分离得到粗盐和含有镁离子、溴离子的苦卤,向苦卤溶液中加入生石灰,发生反应CaO+H2O=Ca(OH)2、Mg2++2OH-=Mg(OH)2↓,向含有溴离子的溶液中加入氯水,发生反应2Br-+Cl2=2Cl-+Br2,然后萃取得到Br2,将Mg(OH)2溶于稀盐酸得到MgCl2,电解熔融氯化镁得到Mg,MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,提纯粗盐得到精盐,电解饱和食盐水得到烧碱、氯气和氢气,反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
(1)海水淡化的方法主要有蒸馏法、离子交换法、电渗析法(填一种),
故答案为:蒸馏法、离子交换法、电渗析法(填一种);
(2)①②两步所加试剂分别是石灰乳、氯水,离子反应方程式分别为Mg2++2OH-=Mg(OH)2、Cl2+2Br-=Br2+2Cl-,
故答案为:石灰乳;Mg2++2OH-=Mg(OH)2;氯水;Cl2+2Br-=Br2+2Cl-;
(3)③④⑤分别发生的反应为Mg(OH)2+2 HCl=MgCl2+2H2O、MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑、2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,故答案为:Mg(OH)2+2 HCl=MgCl2+2H2O;MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
点评 本题考查海水资源综合利用,涉及物质分离和提纯、金属冶炼等知识点,明确流程图中发生的反应及基本操作是解本题关键,知道常见金属冶炼方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用碳酸钠溶液可以洗涤油污 | B. | 用pH试纸可以测定土壤的酸碱性 | ||
| C. | 用明矾可以对自来水杀菌病毒 | D. | 含氟牙膏可以有效防止龋齿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36g H2O中含有氧原子数为2NA | |
| B. | 标准状况下,11.2L苯所含分子数为0.5NA | |
| C. | 1L 1 mol•L-1硫酸钠溶液中,所含钠离子数为NA | |
| D. | 1mol H2在O2中完全燃烧转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气光照条件下反应,反应类型为取代反应;乙烯可以使溴水褪色,发生加成反应 | |
| B. | 不能用酸性高锰酸钾溶液鉴别乙酸和乙醇 | |
| C. | 乙醇在铜做催化剂并加热条件下生成乙醛,发生催化氧化反应 | |
| D. | 生活中可以用食醋除去水壶中的水垢,主要是利用了食醋中醋酸的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题:
如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 秸秆就地焚烧 | B. | 秸秆粉碎还田 | C. | 秸秆生产沼气 | D. | 秸秆造纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2
现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com