
| A. | 碘易升华,应该密封保存 | |
| B. | 液溴应保存在磨口玻璃塞深棕色细口试剂瓶中,并加少量水进行水封 | |
| C. | 酒精与水互溶,所以不能用酒精把碘从碘水中萃取出来 | |
| D. | 用加热的方法可以将NH4Cl与碘的混合物分离 |
分析 A.碘见光易升华;
B.液溴易挥发,需液封;
C.酒精与水混溶,不能用作萃取剂;
D.氯化铵易分解,碘易升华.
解答 解:A.碘见光易升华,应保存在棕色瓶中密封保存,故A正确;
B.溴单质易挥发,应在盛溴的试剂瓶里加一些水来防止溴挥发,水封法保存,应保存在磨口玻璃塞深棕色细口试剂瓶中,故B正确;
C.萃取剂的选择原则是:与水互不相溶,被萃取的物质在该溶剂中的溶解度比在水中的溶解度大,且跟萃取物不发生化学反应,酒精与水混溶,不能用作萃取剂,可用苯或四氯化碳萃取,故C正确;
D.氯化铵加热易分解,冷却后又可生成氯化铵,碘加热时易升华,冷却后又生成碘固体,不能用加热的方法分离,故D错误;
故选:D.
点评 本题考查试剂的存放,明确物质的性质与保存方法的关系是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>R>W | |
| B. | 气态氢化物稳定性:HmW>HnR | |
| C. | XW4分子中各原子均满足8电子结构 | |
| D. | Y、Z、R三种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ②④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
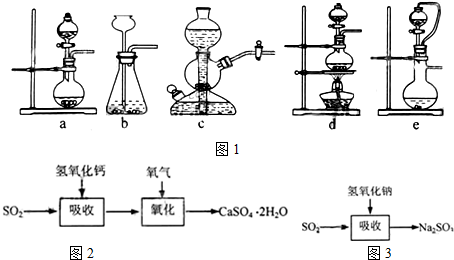
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| NH3 | C2H2 | CCl4 | CO2 |
| A. | A、 | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
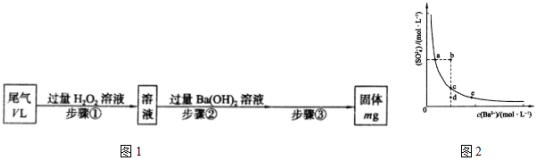
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、NO3- | B. | Na+、Cl- | C. | Na+、NO3- | D. | Cl-、Na+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com