
【题目】碳、硫和氮的氧化物与大气污染密切相关,对CO2、SO2和NO2的研究很有意义.
(1)科学家发现NOx与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(g) ![]() NaNO3(g)+ClNO(g) ΔH1<0(平衡常数为K1)
NaNO3(g)+ClNO(g) ΔH1<0(平衡常数为K1)
II:2NO(g)+ Cl(g) ![]() 2ClNO(g) ΔH2<0(平衡常数为K2)
2ClNO(g) ΔH2<0(平衡常数为K2)
III:4NO2(g)+2NaCl(g) ![]() 2NaNO2(g)+2NO(g)+Cl2(g) ΔH3 (平衡常数为K3)
2NaNO2(g)+2NO(g)+Cl2(g) ΔH3 (平衡常数为K3)
反应III中K3=___________(用K1、K2表示),ΔH3 =_______(用ΔH1、ΔH2表示)。若反应II在恒温、恒容条件下进行,能判断该反应一定达到平衡状态的标志是________________。
A.容器内混合气体的压强保持不变
B.v正(NO)=v逆(Cl2)
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均相对分子质量保持不变
(2)汽车尾气中排放的NOx和CO会污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOx和CO的排放,为了模拟应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如下表:
时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
平衡时,NO的转化率ɑ(NO)=_________________,
此溫度下,该反应的平衡常数K=_______________。
(3)科学家提出由CO2制取C的工艺如图所示。已知:在重整系统中n(FeO): n(CO2)=5 : 1则在“热分解系统”中,FexOy的化学式为__________________。

(4)NQx可“变废为宝”,由NO电解可制备NH4NO3,其工作原理如图所示(M、N为多孔电极)。为使电解产物全部转化为NH4NO3,需向电解产物中补充适量NH3。电解时M和电源________极(填“正或负”)相连,书写N极发生的电极反应式_____________________。
【答案】 ![]() 2ΔH1-ΔH2 ABD 90% 5×l03或5000 Fe5O7 负 NO-3e-+2H2O=
2ΔH1-ΔH2 ABD 90% 5×l03或5000 Fe5O7 负 NO-3e-+2H2O=![]() +4H+
+4H+
【解析】(1)2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 △H<0 (I),2NO(g)+Cl2(g)
NaNO3(s)+ClNO(g) K1 △H<0 (I),2NO(g)+Cl2(g)![]() 2ClNO(g) K2 △H<0 (II),根据盖斯定律,Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)
2ClNO(g) K2 △H<0 (II),根据盖斯定律,Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=K12/K2,ΔH3 =2ΔH1-ΔH2,A.反应前后气体物质的量变化,容器内压强不再变化,说明反应达到平衡状态,故A正确;B.反应速率之比等于化学方程式计量数之比,υ 正 ( NO )=υ正 ( Cl2 ),υ 正 ( NO )=υ 逆 ( Cl2 )说明正逆反应速率相同,故B正确;C.质量和体积不变,气体混合气体密度始终不变,不能说明反应达到平衡状态,故C错误;D.该反应属于气体的物质的量发生变化的反应,气体的质量不变,因此混合气体的平均相对分子质量保持不变,能说明反应达到平衡状态,故D正确;故答案为:K12/K2;2ΔH1-ΔH2;ABD;
2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=K12/K2,ΔH3 =2ΔH1-ΔH2,A.反应前后气体物质的量变化,容器内压强不再变化,说明反应达到平衡状态,故A正确;B.反应速率之比等于化学方程式计量数之比,υ 正 ( NO )=υ正 ( Cl2 ),υ 正 ( NO )=υ 逆 ( Cl2 )说明正逆反应速率相同,故B正确;C.质量和体积不变,气体混合气体密度始终不变,不能说明反应达到平衡状态,故C错误;D.该反应属于气体的物质的量发生变化的反应,气体的质量不变,因此混合气体的平均相对分子质量保持不变,能说明反应达到平衡状态,故D正确;故答案为:K12/K2;2ΔH1-ΔH2;ABD;
(2) 根据表格数据,平衡时,NO的转化率ɑ(NO)= ![]() ×100%=90%;此溫度下,平衡时,NO、CO、N2、CO2的浓度分别为1.0×10-4mol/L、2.7×10-3mol/L、4.5×10-4mol/L、9.0×10-4mol/L,该反应的平衡常数K=
×100%=90%;此溫度下,平衡时,NO、CO、N2、CO2的浓度分别为1.0×10-4mol/L、2.7×10-3mol/L、4.5×10-4mol/L、9.0×10-4mol/L,该反应的平衡常数K=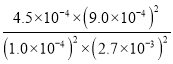 =5000,故答案为:90%;5000;
=5000,故答案为:90%;5000;
(3)由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中n(FeO):n(CO2)=5:1,根据Fe原子、O原子守恒可知x:y=5:(5+2)=5:7,故FexOy的化学式为Fe5O7,故答案为:Fe5O7;
(4)电解NO制备NH4NO3,由图可知N为阳极反应为NO-3e-+2H2O=NO3-+4H+,M为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O![]() 3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3。根据以上分析,M为阴极,和电源负极相连N为阳极,反应式为NO-3e-+2H2O=NO3-+4H+,故答案为:负;NO-3e-+2H2O=NO3-+4H+。
3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3。根据以上分析,M为阴极,和电源负极相连N为阳极,反应式为NO-3e-+2H2O=NO3-+4H+,故答案为:负;NO-3e-+2H2O=NO3-+4H+。


科目:高中化学 来源: 题型:
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种碳纳米管新型二次电池的装置如图所示。下列说法中正确的是
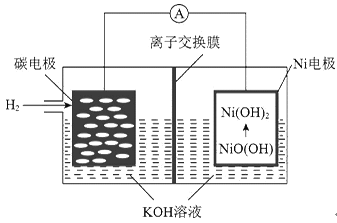
A. 离子交换膜选用阳离子交换膜(只允许阳离子通过) B. 正极的电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
C. 导线中通过1mol电子时,理论上负极区溶液质量增加1g D. 充电时,碳电极与电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )

A. 两烧杯中溶液的pH均增大
B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中铜片表面均无气泡产生
D. 产生气泡的速度甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A. 己知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ/mol,则H2的标准燃烧热为-241.8 kJ/mol
B. 已知C(石墨,s)==C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热置,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
D. 已知 2SO2(g)+O2(g) ![]() 2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g)和lOmol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g)和lOmol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)与铝位于同一主族,金属镓的熔点是29. 8℃,沸点是2403℃,是一种广泛用于电子工业和通讯领域的重要金属。
(1)工业上利用镓与NH3在1000℃高温下合成固体半导体材料氮化镓(GaN),同时生成氢气,每生成lmol H2时放出10.27 kJ热量。
写出该反应.的热化学方程式___________________。
(2)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。

①图1中A点和C点化学平衡常数的大小关系是:KA_____ KC,(填“<”“=”或“>”),理由是____________。
②在T1和P6条件下反应至3min时达到平衡,此时改变条件并于D点处重新达到平衡,H2的浓度随反应时间的变化趋势如图2所示(34 min的浓度变化未表示出来),则改变的条件为________(仅改变温度或压强中的一种)。
(3)气相平衡中用组份的平衡分压(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),用含P6的式子表示B点的Kp=_____________。
(4)电解精炼法提纯嫁的具体原理如下:以粗镓(含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH溶液为电解质,在电流作用下使粗镓溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+3+2+2+。电解精炼镓时阳极泥的成分是________________。
②镓在阳极溶解生成的Ga3+与.NaOH溶液反应生成GaO2-,该反应的离子方程式为_________________;
GaO2-在阴极放电的电极反应式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲烷燃烧生成CO2和液态水时放热55.625 kJ。则表示甲烷燃烧热的热化学方程式为________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为______________。
(3)在25 ℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(1)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)===CH3COOH(1)的反应热ΔH为________。
II、锌锰干电池是应用最普遍的电池之一。其基本反应为:
X极:Zn-2e-===Zn2+
Y极:2MnO2+2NH![]() +2e-===Mn2O3+2NH3+H2O
+2e-===Mn2O3+2NH3+H2O
(1)X是电池的________(填“正”或“负”,下同)极,Y是电池的________极。
(2)该电池总反应的离子方程式为:_______________________。
(3)若反应消耗16.25gZn,则电池中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法错误的是
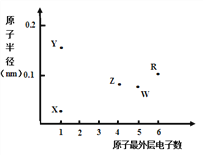
A. 简单离子半径:Y < W
B. 最高价氧化物对应水化物的酸性:Z < W
C. R为氧元素
D. X与Z可以形成正四面体结构的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,环境问题越来越引起人们的重视。温室效应、酸雨、臭氧层被破坏、赤潮等已经给我们赖以生存的环境带来较大的影响,造成酸雨的主要有害物质是
A. CO2B. 硫和氮的氧化物
C. 含氟化合物D. 化肥和含磷洗衣粉的使用及其污水的排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com