
【题目】下列有关实验的描述中,正确的是
①钠放入水中后,沉在水下缓缓冒出气体
②Na2CO3和NaHCO3的溶液都可以使无色酚酞试液变红
③氢气在氧气或氯气中燃烧,都能观察到淡蓝色火焰
④将某气体通入品红溶液中,红色褪去,说明该气体一定是SO2
⑤向某溶液中加入烧碱溶液,加热后生成使湿润红石蕊试纸变蓝的气体,说明原溶液中有NH4+。
⑥过氧化钠与水反应放出大量热
A. ①③⑥ B. ②④⑤ C. ②⑤⑥ D. ③④⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】目前我国锅炉烟气脱硝技术有新发现,科学家对O3氧化烟气脱硝同时制硝酸进行了实验研究,其生产硝酸的机理如下:
![]()
回答下列问题:
(1)NO3分子内存在两个过氧键,且氧均满足8电子稳定结构,请写出NO3中N的化合价______;NO3极不稳定,常温下即可爆炸分解,试从电子成键角度解释NO3不稳定的原因:______。
(2)N2O5与O3作用也能生成NO3与氧气,根据反应前后同种元素,价态相同,不参与氧化还原反应的原则,请分析反应N2O5+O3=2NO3+O2中,N2O5的作用是______(填“氧化剂”“还原剂”或“既是氧化剂,又是还原剂”)。
(3)请写出在有水存在时,O3与NO以物质的量之比为3∶2完全反应的总化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为______。
(2)反应前A的物质的量浓度是_______。
(3)10 s末,生成物D的浓度为______。
(4)A与B的平衡转化率之比为_______。
(5)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度____;
②增大压强____
③增大A的浓度_____;
④恒容下充入Ne______。
(6)下列叙述能说明该反应已达到化学平衡状态的是(填标号)_____;
A.v(B)=2v(C)
B.容器内压强不再发生变化
C.A的体积分数不再发生变化
D.器内气体密度不再发生变化
E.相同时间内消耗n mol的B的同时生成2n mol的D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:

已知:i.部分离子完全生成氢氧化物沉淀的pH
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为___________。
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是_______(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有______________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2+ +________+4H2O +H2O2 =_______ + 4NH3·H2O
(5)电解制备过二硫酸铵的装置如下图所示。

①S2O82-中S元素的化合价为+6,其中过氧键的数目为___________。
②电解时,铁电极连接电源的___________极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。

在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为______,阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 Na2CO3 和NaHCO3的说法中正确的是
A. 热稳定性: NaHCO3比Na2CO3稳定
B. 常温时,在水中的溶解性: Na2CO3>NaHCO3
C. 氢氧化铝和纯碱常用来治理胃酸过多
D. 它们都属于盐类,所以水溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写错误的是
A. HCO3-的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. Cu2+的水解方程式:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
C. NH4+的水解方程式:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Mg(OH)2的溶解平衡时,利用下表三种试剂进行试验,下列说法中不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1 mol/L | 1 mol/L |
A. 向①中滴入几滴酚酞试液后,溶液显红色说明Mg(OH)2是一种弱电解质
B. 为了使Mg(OH)2悬浊液溶解得更快,加入过量的NH4Cl浓溶液并充分振荡,效果更好
C. ①、③混合后发生反应:Mg(OH)2(s)+2NH4+(aq)![]() Mg2+(aq)+2NH3·H2O(aq)
Mg2+(aq)+2NH3·H2O(aq)
D. 向①中加入②,H+与OH—反应生成H2O,使c(OH-)减小,Mg(OH)2溶解平衡向溶解方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯M常用作调制具有草莓、葡萄、樱桃等香味的食用香精。M属于芳香化合物,苯环上只含一个直支链,能发生加聚反应和水解反应。测得M的摩尔质量为162 g·mol-1,只含碳、氢、氧三种元素,且原子个数之比为5∶5∶1。
(1)肉桂酸甲酯的结构简式是___________________________。
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间连线表示单链或双键)。G的结构简式为_____________。
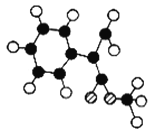
(3)以芳香烃A为原料合成G的路线如下:
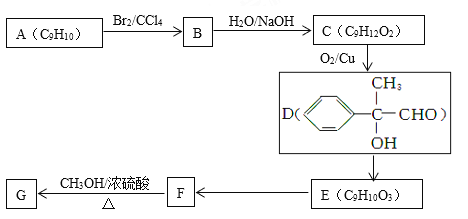
①化合物E中的含氧官能团有_____________(填名称)。
②E→F的反应类型是__________,F→G的化学方程式为______________________。
③符合下列条件的F的同分异构体中:
Ⅰ.分子内含苯环,且苯环上只有一个支链;不含“―O―O―”和“―C≡C―”;
Ⅱ.在催化剂作用下,1 mol该物质与足量氢气充分反应,消耗5 mol H2;
Ⅲ.它不能发生水解反应,不能发生酯化反应。
其中能与银氨溶液反应,且1mol该有机物与析出的银的物质的量之比为1∶4的是_________________________________(写结构简式);其中核磁共振氢谱图中有6个峰,且峰面积之比为1∶1∶1∶1∶2∶2的是 _________________________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。用pH计测定25 ℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度/mol·L-1 | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(1)写出醋酸的电离方程式:__________________________。
(2)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是__________________。
(3)向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为____
(4)25℃,将0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后溶液的pH=10,则该混合溶液中由水电离出的c(OH-)=___________mol/L,写出该混合溶液中下列算式的精确结果(不能做近似计算),c(Na+)-c(CH3COO-)=______________mol/L。
(5)下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是___________
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量镁粉 f.加入少量0.10 mol·L-1的NaOH溶液
(6)室温时醋酸的电离常数Ka=1.8×10-5 ,则CH3COO-的水解常数Kh= ____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com