
| A. | H2O3?2H++CO32- | B. | CH3COO-+H2O?CH3COOH+OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | BaOH)2?Ba2++2OH- |
分析 A.碳酸为二元弱酸分步电离;
B.醋酸根离子水解生成醋酸和氢氧根离子;
C.碳酸氢钠为强电解质,完全电离,用等号;
D.氢氧化钡为强电解质,完全电离,用等号.
解答 解:A.碳酸的电离方程式:H2O3?H++HCO3-,HCO3-?H++CO32-,故A错误;
B.醋酸根离子水解生成醋酸和氢氧根离子,水解离子方程式:CH3COO-+H2O?CH3COOH+OH-,故B正确;
C.碳酸氢钠电离方程式:NaHCO3=Na++HCO3-,故C错误;
D.氢氧化钡电离方程式:BaOH)2=Ba2++2OH-,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,侧重考查电解质电离、盐类水解的离子方程式书写,明确电解质强弱及电离方式是解题关键,注意弱电解质电离、单离子盐水解用可逆号,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用氨水除去试管内壁上的银镜 | |
| B. | 用通入氢气的方法除去乙烷中的乙烯 | |
| C. | 用点燃的方法鉴别乙醇、苯和四氯化碳 | |
| D. | 用溴水鉴别苯、甲苯和乙苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②③④ | C. | ②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯加入到溴水中,将会和溴发生取代反应而使溴水褪色 | |
| B. | 在空气中灼烧铜丝,待铜丝冷却后伸入乙醇中,反复多次,可以制得乙醛 | |
| C. | 在洁净的试管中加入1~2mL的AgNO3溶液,再滴加稀氨水,直到AgOH完全沉淀,即制得银氨溶液 | |
| D. | 将10%的葡萄糖溶液加入新制氢氧化铜溶液中,加热可得到砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
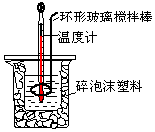 用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.
用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.| 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
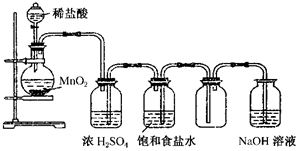 如图所示是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题.
如图所示是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com