
| A. | Fe3+ NH4+ SCN- Cl- | B. | Fe3+ Fe2+ Na+ NO3- | ||
| C. | Ba2+ H+ NO3- SO42- | D. | S2- Na+ ClO- OH- |
分析 A.铁离子与硫氰根离子反应生成硫氰化铁;
B.四种离子之间不发生反应,能够共存;
C.钡离子与硫酸根离子反应生成硫酸钡沉淀;
D.次氯酸根离子能够氧化硫离子.
解答 解:A.Fe3+、SCN-之间发生络合反应生成硫氰化铁,在溶液中不能大量共存,故A错误;
B.Fe3+、Fe2+、Na+、NO3-之间不反应,能够大量共存,故B正确;
C.Ba2+、SO42-之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故C错误;
D.S2-、ClO-之间发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 将试剂瓶中的Na2CO3溶液倒入试管,发现取量过多,将过量的试剂倒回试剂瓶中 | |
| B. | 将含有Ba(NO3)2的废液倒入指定的容器中回收 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,立刻转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,其结构和物理性质和苯相似,称为“无机苯”,该物质的二氯代物有4种.
,其结构和物理性质和苯相似,称为“无机苯”,该物质的二氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
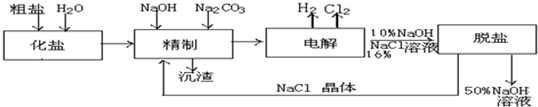
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛浓硝酸、硝酸银用棕色试剂瓶,并置于阴凉处 | |
| B. | 用带玻璃塞的磨口玻璃瓶盛氢氧化钠 | |
| C. | 金属钠通常保存在煤油里 | |
| D. | HF酸储存在塑料瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mLNO | B. | 8mLNO2和4mLO2 | C. | 2mLO2 | D. | 0.25mLO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
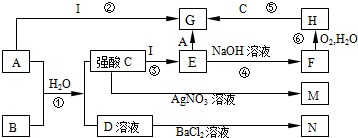
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.25mol•L-1 | B. | 2mol•L-1 | C. | 0.6mol•L-1 | D. | 0.3mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com