
化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s)+H2O(g)CO(g)+H2(g),该反应的化学平衡常数表达式为K=________。
若反应的逆反应速率与时间的关系如图所示:
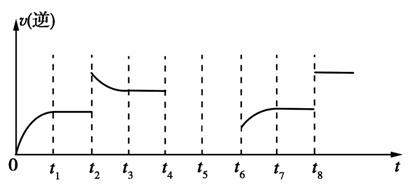
①可见反应在t1、t3、t7,时都达到了平衡,而t2、t8时都改变了一种条件,试判断t2时改变的是什么条件:t2时________________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应:________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是________________。
解析:(1)固体不写入平衡常数表达式中。①观察图像可知t2时逆反应速率突然增大,并且平衡逆向移动,所以改变的条件可能是增大压强或增大生成物浓度。该反应是吸热反应,升高温度平衡正向移动,而加入催化剂对平衡移动无影响,所以不可能是升高温度或使用催化剂。②若t4时降压,正、逆反应速率突然减小,平衡正向移动,正反应速率大于逆反应速率,在趋于平衡的过程中逆反应速率逐渐增大,平衡时与t6时v(逆)相等。(2)①反应器中发生反应的化学方程式为I2+SO2+2H2O===H2SO4+2HI,改写成离子方程式即可。②该循环工艺的目的之一是制备氢气,而HI分解生成H2与I2(g)的反应是可逆反应,为了增大H2的产率,使平衡正向移动,需要不断地分离出氢气。
答案:(1)c(CO)·c(H2)/c(H2O)(2分)
①增大压强或增大生成物浓度(2分)
②
(2)①SO2+I2+2H2O===4H++SO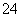 +2I-(2分)
+2I-(2分)
②降低生成物的浓度,使平衡正向移动(2分)


科目:高中化学 来源: 题型:
某无色溶液中能大量共存的一组离子是 ( )
A.OH-、Ba2+、NH4+、Cl- B.Na+、Al3+、Cl-、NO3-
C .K+、Fe2+、H+、NO3- D.Mg2+、SO42-、SiO32- 、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是( )
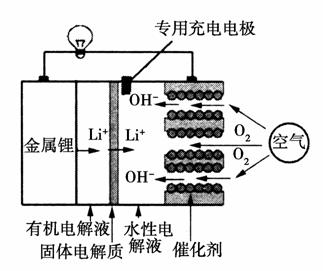
A.该电池放电时,正极的反应式为O2+4e-+4H+===2H2O
B.该电池充电时,阴极发生了氧化反应:Li++e-===Li
C.电池中的有机电解液可以用稀盐酸代替
D.正极区产生的LiOH可回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)CH3OH(g) ΔH<0。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
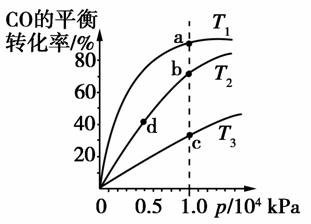
A.平衡常数:K(a)>K(c) K(b)=K(d)
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平均摩尔质量: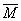 (a)<
(a)<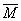 (c)
(c) 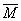 (b)>
(b)>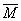 (d)
(d)
D.平衡时a点一定有n(CO):n(H2)=1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知(HF)2(g)2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )
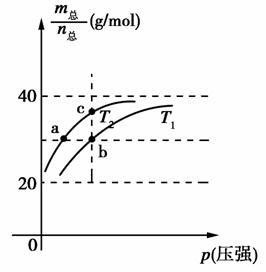
A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:vb>va
D.当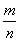 =30 g/mol时,n(HF):n[(HF)2]=2:1
=30 g/mol时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
俗话说“雷雨发庄稼”,这说明雷雨中含有能被植物吸收利用的化合态的氮,请同学们 写出三个有关的化学方程式:
(1)________________________________________________________________________;
(2)________________________________________________________________________;
(3)________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
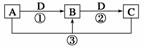
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是__________;工业上制取A的离子方程式为______________________________________________________________________
________________________________________________________________________。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为________________________________________________________。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是________________________________________________________________________
______________________________________________________ __________________。
__________________。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为________________________________________________________________________
________________________________________________________________________。
某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

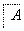


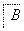
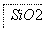

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:________________
(注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为________________(填代号)。
a.氢氧化钠溶液 b.硫酸溶液
c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、________(填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成:
 Fe2++
Fe2++ ClO-+
ClO-+ __________===
__________=== Fe(OH)3↓+
Fe(OH)3↓+ Cl-+
Cl-+ ________
________
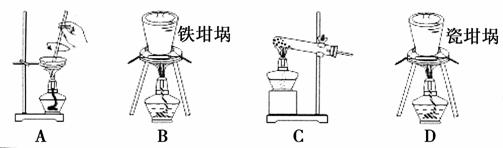
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为________(填代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com