
| 浓硝酸 |
| 一定量NaOH |
| D的溶液 |


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
| A、同种胶体带同种电荷,相互排斥,是胶体稳定的主要原因 |
| B、生石灰与水混合的过程只发生物理变化 |
| C、O3是由3个氧原子构成的化合物 |
| D、可用丁达尔效应区分溶液与胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg和Al |
| B、Al和Zn |
| C、Cu和Zn |
| D、Mg和Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
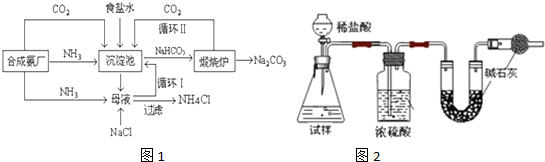
| 盐 | NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3?10H2O |
| 10℃ | 35.8 | 33.3 | 8.1 | 15.8 | 12.5 |
| 20℃ | 36.0 | 37.2 | 9.6 | 21 | 21.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,8gO2含有4NA个电子 |
| B、1L1mol/L的K2SO4中有NA个K+ |
| C、标准状况下,22.4L盐酸含有NA个HCl分子 |
| D、1molNa被完全氧化生成Na2O2,失去个NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3 | B、1:4 |
| C、4:1 | D、3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com