
分析 (1)分解反应是吸热反应且生成的氧化镁、氧化铝的熔点高,生成的水蒸气稀释空气;
(2)氧化镁是碱性氧化物,氧化铝是两性氧化物,依据二者性质不同除去.
解答 解:(1)2Mg5Al3(OH)19(H2O)4$\frac{\underline{\;\;△\;\;}}{\;}$27H2O↑+10MgO+3Al2O3 ,分解反应是吸热反应,降低温度,生成的氧化镁和氧化铝都是熔点很高的氧化物,附着表面会阻止燃烧,水蒸气稀释空气,降低氧气浓度,
故答案为:反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气;
(2)氧化镁是碱性氧化物溶于酸,氧化铝是两性氧化物溶于酸、溶于碱,加入氢氧化钠溶解后过滤除去,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查了镁铝化合物性质,主要是氧化镁、氧化铝性质的熟练掌握,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体 BaSO4 | B. | 铜 二氧化硫 | ||
| C. | 液态的醋酸 酒精 | D. | 熔融的KNO3 硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
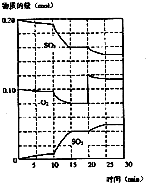 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应的进行程度越大,K值大小与温度的关系是:温度升高,K值可能增大也可能减小(填一定增大、一定减小、或可能增大也可能减小).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| N(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量氨水:A13++4 NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | NaA1O2溶液中AlO2-的水解:AlO2-+2H2O═A1(OH)3↓+OH- | |
| C. | AgCl悬浊液中加入KI溶液得到黄色沉淀:Ag++I-═AgI↓ | |
| D. | 明矾净水原理:A13++3H2O?A1(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 增大压强,正逆反应的化学反应速率都减小 | |
| C. | 升高温度,正反应化学反应速率增大,逆反应化学反应速率减 | |
| D. | 对该反应来说,无沦反应进行到何时,混合气体的总物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 | |
| B. | 电池的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 电解后电池中c(KOH)不变;c(Na2CO3)不变 | |
| D. | 电解后电解池中溶液pH变大,且溶液中有晶体析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com