
【题目】海水中有丰富的资源,多种多样的海洋动物、植物、矿藏等。如图是从海水中提取某些物质的示意图。已知:海水中含量最高的几种离子的浓度依次为
微粒种类 | Cl- | Na+ | Mg2+ |
| Ca2+ |
微粒浓度 | 0.55mol·L-1 | 0.47mol·L-1 | 0.054mol·L-1 | 0.027mol·L-1 | 0.01mol·L-1 |
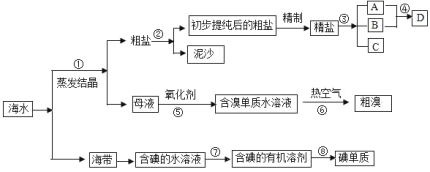
请根据以上信息回答下列问题:
(1)写出步骤②的操作名称_______;实验室中步骤⑤所需的玻璃仪器除烧杯外,还需要的仪器是___________。
(2)D具有杀菌消毒的作用,请写出反应④的离子方程式___________。
(3)初步提纯后的粗盐中含有等Ca2+、Mg2+、![]() 等杂质,精制得到精盐的步骤顺序为________。(用字母序号填空)
等杂质,精制得到精盐的步骤顺序为________。(用字母序号填空)
a.加适量盐酸;b.加稍过量的氯化钡溶液,再加稍过量的NaOH溶液;c.过滤;d.蒸发结晶;e.加稍过量碳酸钠溶液
(4)____________(填“能”或“不能”)用![]() 一种试剂替代步骤②中两种试剂,理由是________。
一种试剂替代步骤②中两种试剂,理由是________。
【答案】过滤 导气管 Cl2+2OH-=Cl-+ClO-+H2O becad 能 Mg2+、SO42-均可转化为沉淀,简化操作
【解析】
海水中还含有大量的电解质,它们电离产生Cl-、Br -、I-、SO42-、Na+、Mg2+、Ca2+等,通过蒸发浓缩得到粗盐和卤水为母液,粗盐通过过滤除去泥沙得到初步提纯的粗盐,加入试剂除去杂质离子精制得到精盐,制成饱和溶液电解得到氢氧化钠、氯气、氢气,D具有杀菌消毒的作用说明为次氯酸钠,说明AB为氯气和氢氧化钠,C为氢气,母液中含有溴离子、镁离子等,加入氧化剂可氧化溴离子为溴单质,利用溴单质具有易挥发性用热空气吹出溴单质,得到粗溴;海带灼烧溶解得到含碘离子的水溶液,加入氧化剂氧化碘离子为碘单质,加入有机萃取剂萃取碘单质,分液后的有机层蒸馏得到碘单质,以此来解答。
(1)操作②是分离溶液和固体,用过滤操作,所以步骤②为过滤,反应⑤所用的气态氧化剂为氯气,在烧杯中利用导气管通入氯气;
(2)反应④是氯气和氢氧化钠反应生成次氯酸、氯化钠和水,化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,离子反应为Cl2+2OH-=Cl-+ClO-+H2O;
(3)因用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入氯化钡之后,碳酸钠会除去过量的氯化钡,过滤后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为becad;
(4)能用Ba(OH)2一种试剂替代步骤②中两种试剂,理由是Mg2+、SO42-均可转化为沉淀,简化操作。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由C元素形成的单质,已知甲+乙=丁+己,甲+丙=戊+己,0.1mol·L-1丁溶液的pH为13(25℃)。下列说法正确的是
A. 原子半径:D>C >B>A
B. B元素只能形成一种二元含氧酸,且B元素的含氧酸对应的酸酐一定是氧化物
C. 1mol甲与足量乙反应转移电子的数目为NA
D. 1.0L 0.1mol·L-1戊溶液中阴离子总的物质的量小于0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。

(1)A中铁元素发生反应的离子方程式有______________________________________________________。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验:取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在______(填化学符号)。
(3)资料显示:SCN--的电子式为 ![]() 。甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究:取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN― 中被氧化的元素是___________(填名称)。
。甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究:取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN― 中被氧化的元素是___________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃(只含有1个双键)与H2加成后的产物是CH3CHCH3CHCH3C(CH3)3,则该烯烃的结构式可能有
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:探究草酸的制备
实验室用硝酸氧化淀粉水解液法制备草酸:C6H12O6+12HNO3 → 3H2C2O4+9NO2↑+3NO↑+9H2O。装置如下图所示:
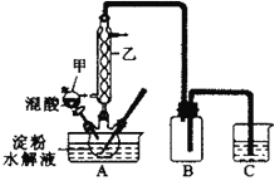
(1)上图实验装置中仪器乙的名称为:___________,B装置的作用____________。
(2)检验淀粉是否完全水解所需要的试剂为:__________。
实验Ⅱ:探究草酸的不稳定性
已知:草酸晶体(H2C2O4·2H2O)无色,易溶于水,熔点为101℃,受热易脱水、升华,170℃以上分解产生H2O、CO和CO2。草酸的酸性比碳酸强,其钙盐难溶于水。
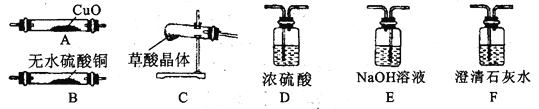
(3)请选取以上的装置证明草酸晶体分解的产物(可重复使用,加热装置和连接装置已略去)。仪器装置连接顺序为:C→______→______→______→______→D→A→F______
(4)若实验结束后测得A管质量减轻4.8g,则至少需分解草酸晶体的质量为_____g(已知草酸晶体的M=126g/mol)。
实验Ⅲ:探究草酸与酸性高锰酸钾的反应
(5)取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)
该实验中草酸表现______性,该反应的离子方程式_____________________________________________,该反应的反应速率先慢后快的主要原因可能是___________________。
(6)设计实验证明草酸是弱酸。实验方案:________________________________ (提供的药品及仪器:蒸馏水、0.1mol·L-1NaOH溶液、pH计、0.1mol·L-1草酸溶液,其它仪器自选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工水平的标志,乙烯有如下转化关系。
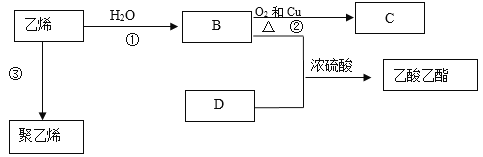
请回答下列问题:
(1)乙烯的结构简式为______。
(2)B所含官能团的名称为____________。
(3)③的反应类型是____________。
(4)浓硫酸的作用是________________。
(5)反应①的化学方程式为________________________________________________。
反应②的化学方程式为_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是

A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水晒盐得到的粗盐中还含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,以下是实验室制备精盐的实验方案:

(1)除去泥沙和沉淀选用图中___装置,B装置的操作名称是___,在上述方案中图中装置中不会用到的是___。
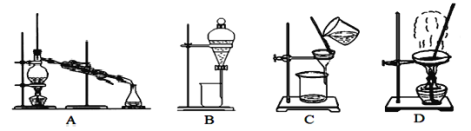
(2)第⑦步操作的名称是___,所用到的实验装置是图中的___(填字母);
(3)为除去粗盐中的可溶性杂质,通常采用以下三种试剂,a:Na2CO3溶液;b:BaCl2溶液;c:NaOH溶液,加入BaCl2试剂的目的是___,三种试剂加入的合理顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是___。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是______________。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
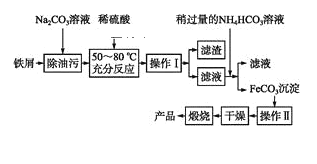
回答下列问题:
①操作Ⅰ的名称是____,操作Ⅱ的名称是____。②写出在空气中煅烧FeCO3的化学方程式________________。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a.称取2.850 g绿矾(FeSO4·7H2O)产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液放入锥形瓶中;
c.用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①达到滴定终点时的现象____。
②某同学设计的下列滴定方式,最合理的是____。(夹持部分略去)(填字母序号)

③计算上述样品中FeSO4·7H2O的质量分数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com