
| A. | 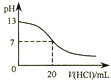 图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 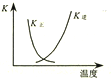 图中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 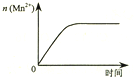 图③表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 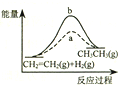 图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
分析 A.当溶液pH=7时,氢氧化钠就与氯化氢恰好反应,滴定曲线应该有一个滴定突变;
B.升高温度,平衡逆向越大,正反应平衡常数减小、逆反应的平衡常数增大,相同温度下二者乘积为1;
C.溶液中离子浓度等因素影响反应速率,随反应进行反应速率变化,Mn2+的物质的量与时间不呈线性关系;
D.使用催化剂降低活化能,不影响反应热,该反应是放热反应,应反应物的总能量大于生成物的总能量.
解答 解:A.用盐酸滴定氢氧化钠溶液,当恰好中和时溶液的pH=7,酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,题中图象变化与实际不相符,故A错误;
B.因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K(逆)会增大,而K(正)会减小,且正逆反应的平衡常数互为倒数关系,图象中变化与实际上的变化相符,故B正确;
C.溶液中离子浓度等因素影响反应速率,随反应进行反应速率变化,Mn2+的物质的量与时间不呈线性关系,故C错误;
D.图象a活化能减小,a使用了催化剂,因该反应是放热反应,应反应物的总能量大于生成物的总能量,但图象描述是吸热反应,故D错误.
故选:B.
点评 本题考查酸碱中和滴定、平衡常数影响因素、反应速率影响因素、化学反应中能量变化等,侧重考查学生读图获取信息的能力、知识迁移运用能力,主要考查一些细节问题,属于易错题目.


科目:高中化学 来源: 题型:选择题
| A. | 合成高效、稳定、廉价的太阳能光电转化材料,是开发利用太阳能的关键 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”的分散质微粒相同 | |
| C. | 肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水” | |
| D. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
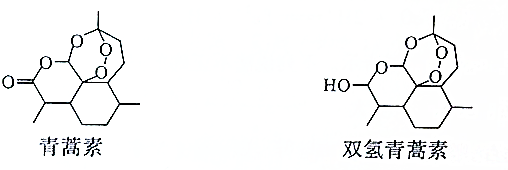
| A. | 双氢青篙素属于脂类物质 | |
| B. | 青蒿素的分子式为C15H21O5 | |
| C. | 青蒿素环上的一氯取代物有11种 | |
| D. | 青蒿素通过加成反应可以转化为双氢青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
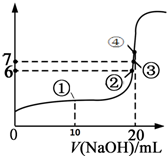 25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题:
25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.
CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA的浓度(mol/L) | NaOH的浓度(mol/L) | 混合溶液的PH |
| 甲 | 0.2 | 0.2 | PH=a |
| 乙 | C1 | 0.2 | PH=7 |
| 丙 | 0.1 | 0.1 | PH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
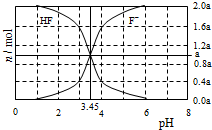 25°C时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1氢氟酸溶液,得到混合液中HF、F一的物质的量与溶液pH的变化关系如图所示.下列说法正确的是
25°C时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1氢氟酸溶液,得到混合液中HF、F一的物质的量与溶液pH的变化关系如图所示.下列说法正确的是| A. | pH=3时,溶液中:c(Na+)<c(F一) | |
| B. | c(F一)>c(HF)时,溶液一定呈碱性 | |
| C. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2amol•L-1 | |
| D. | pH=3.45时,NaOH溶液恰好与HF完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能将E从HE的溶液中置换出来 | |
| B. | 气态氢化物的稳定性:D>A>B | |
| C. | 离子半径由大到小的顺序是A>J>H | |
| D. | 最高价氧化物的水化物的碱性:H>I>J |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com