
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
分析 由元素在周期表中的位置可知,①是Na、②是K、③是Mg、④是Al、⑤是C、⑥是O、⑦是Cl、⑧是Br、⑨是Ar.
(1)稀有气体原子最外层为稳定结构,化学性质最不活泼;
(2)金属性越强,最高价氧化物对应水化物碱性越强;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
(5)同主族自上而下非金属性减弱,非金属性越强,最高价氧化物对应水化物酸性越强;
(6)氯气与水反应生成HCl与HClO.
解答 解:由元素在周期表中的位置可知,①是Na、②是K、③是Mg、④是Al、⑤是C、⑥是O、⑦是Cl、⑧是Br、⑨是Ar.
(1)稀有气体原子最外层为稳定结构,Ar的化学性质最不活泼,故答案为:Ar;
(2)同周期自左而右金属性减弱,同主族自上而下金属性增强,故金属性K>Na>Mg,金属性越强,最高价氧化物对应水化物的碱性越强,故减小KOH>NaOH>Mg(OH)2,故答案为:KOH;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K>Na>Mg,故答案为:K>Na>Mg;
(4)各离子的电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+>Mg2+>Al3+,故答案为:Al3+;
(5)非金属性Cl>Br,故最高价氧化物对应水化物的酸性HClO4>HBrO4,故答案为:HClO4;
(6)氯气与水反应生成HCl与HClO,反应离子方程式为:Cl2+H2O?H++Cl-+HClO,故答案为:Cl2+H2O?H++Cl-+HClO.
点评 本题考查元素周期表与元素周期律综合应用,侧重对元素周期律的考查,熟练掌握元素周期表结构与元素化合物性质,比较基础.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 0.37 | 1.86 | 1.43 | 0.99 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +1 | +3 | +7 | +5 | - |
| 最低负价 | -1 | - | - | -1 | -3 | -2 | |
| A. | 离子半径:Y>Z>M | |
| B. | Y、Z、M三种元素的最高价氧化物的水化物两两之间会反应 | |
| C. | 化合物XM、YM都是电解质.熔融状态下都能导电 | |
| D. | 元素Z、M、R的离子均能破坏水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
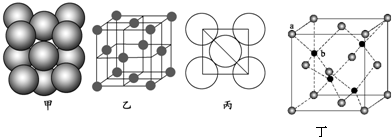
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 v(NH3)=5 v(O2) | B. | 5 v(O2)=6 v(H2O) | C. | 5 v(NO)=4 v(O2) | D. | 3 v(H2O)=2 v(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
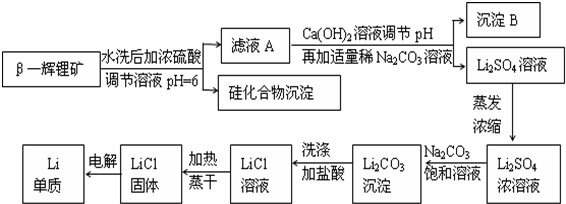
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4比CH4稳定 | |
| B. | O2-半径比F-的小 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | HClO4、H2SO4、H3PO4的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
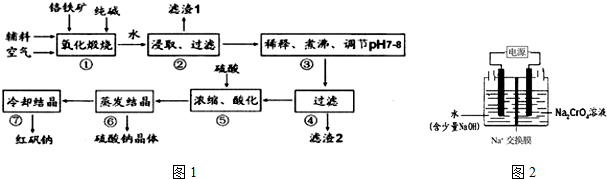
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4中含有共价键的数目为4NA | |
| B. | 常温常压下,6.4 g氧气和臭氧中含有的原子总数为0.4NA | |
| C. | 室温时,1L pH=2的NH4Cl溶液中由水电离出的H+为10-12NA | |
| D. | 一定条件下6.4gSO2与足量氧气反应生成SO3,转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第0族 | B. | 第四周期第ⅠA族 | C. | 第三周期第ⅠA族 | D. | 第三周期第ⅦA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com