
【题目】钠元素广泛存在于自然界,中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。下列关于含钠元素物质的说法错误的是
A. “稻草变黄金”的过程中元素种类没有改变
B. NaCl与Na2CO3灼烧时火焰颜色相同
C. 治疗胃酸过多可以用NaHCO3,糕点生产也可以用NaHCO3
D. 金属钠放置空气中,最终会变成Na2O2
科目:高中化学 来源: 题型:
【题目】如图所示的图解表示构成细胞的元素、化合物,a、b、c、d代表不同的小分子物质,A、B、C代表不同的大分子物质,请分析回答下列问题:
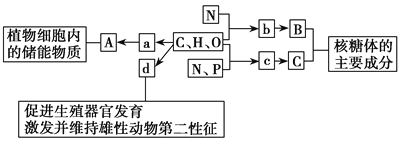
(1)物质a是_________,在动物细胞内,与物质A作用最相近的物质是_________。若物质A在动物、植物细胞中均可含有,并且作为细胞内最理想的储能物质,不仅含能量多而且体积较小,则A是______________。
(2)物质b是____________,若某种B分子由n个b分子(平均相对分子质量为m)组成的2条链组成,则该B分子的相对分子质量大约为____________。
(3)物质c在人体细胞中共有_______种,分子中___________的不同决定了c的种类不同。
(4)物质d是____________,d和__________、维生素D都属于固醇类物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、M、X、Y、Z为原子序数依次增大的前四周期元素,非金属元素W所在周期数等于族序数;M最外层电子数是电子层数的两倍;X与M同族,X单质与O2反应生成化合物XO2;Y 是第三周期原子半径最小的元素;Z是生活中常见金属,既不属于主族,也不属于副族。回答下列问题:
(1) W与M可以形成多种化合物,写出其中最简单化合物的电子式_____________。
(2) 已知:①X的单质结构为( ,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为(
,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为( ,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
②有关键能的数据如下表:
化学键 | X-O | O=O | X-X |
键能(kJ/mol) | 460 | 498.8 | 176 |
写出单质X 在O2中燃烧的热化学方程式________________________。(用具体元素符号书写方程式)
(3) 写出Z的单质与H2O反应的化学方程式_____________________________________。
(4)Y和Z形成的化合物的水溶液呈酸性的原因_______________________________(用离子方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、M 均为短周期元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol/L)溶液的pH和原子半径的关系如图所示。下列说法不正确的是
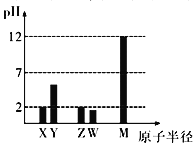
A. X、M 简单离子半径大小顺序:X>M
B. X、Y、Z、W、M 五种元素中只有一种是金属元素
C. Z 的最高价氧化物的化学式为ZO3
D. X、Z的最简单气态氢化物反应有白烟生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事故处理方法正确的是
A.电线短路失火时,用大量的水灭火
B.NaOH浓溶液溅到皮肤,立即用水冲洗,然后涂上稀硼酸溶液
C.浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤
D.钠着火时,立即用水灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) △H1
C2H4(g)+C2H6(g) △H1
副反应:C4H10 (g,正丁烷)![]() CH4(g)+C3H6(g) △H2
CH4(g)+C3H6(g) △H2
回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时释放或吸收的能量叫做生成热,生成热可表示该物质相对能量。下表为25℃、101kPa下几种有机物的生成热:
物质 | 曱烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ·mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
①书写热化学方程式时,要标明“同分异构体名称”,其理由是_______________________。
②上述反应中,△H1=______kJ/mol。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况表明该反应达到平衡状态的是_______(填代号)。
A.气体密度保持不变 B.[c(C2H4)·c(C2H6)]/ c(C4H10)保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
②为了同时提高反应速率和转化率,可采用的措施是________________。
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随若温度升高,乙烯产率降低,可能的原因是__________(填代号)。
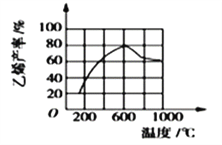
A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1L恒容密闭容器中充入2mol正丁烷,反应生成乙烯和乙烷,经过10min达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10min内乙烯的生成速率v(C2H4)为________mol·L-1·min-1。
②上述条件下,该反应的平衡常数K为____________。
(5)丁烷-空气燃料电池以熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的负极反应式为______________________________。
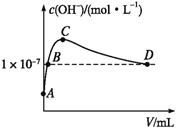
(6)K2CO3可由二氧化碳和氢氧化钾溶液反应制得。常温下,向1 L pH=10的KOH溶液中持续通入CO2,通入CO2的体积(V)与溶液中水电离出的OH-浓度的关系如图所示。C点溶液中各离子浓度大小关系为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 钠与水反应:Na +2H2O![]() Na++2OH– + H2↑
Na++2OH– + H2↑
B. 电解饱和食盐水获取烧碱和氯气:2Cl–+2H2O![]() H2↑+Cl2↑+2OH–
H2↑+Cl2↑+2OH–
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH– + H+ + ![]()
![]() BaSO4↓+H2O
BaSO4↓+H2O
D. SO2溶于水显酸性:SO2 + H2O == 2H+ + SO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com