
 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:分析 (1)熔融固体物质需要再坩埚内加热,加热熔融物含有碱性KOH应用铁坩埚、铁棒、坩埚钳、泥三角、酒精灯;
(2)盐酸具有还原性,会被氧化,降低产品的量;
(3)阳极是锰酸根离子失电子生成高锰酸根离子,与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率;
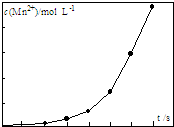
(4)③根据高锰酸钾与草酸钠发生氧化还原反应书写反应的离子方程式;反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好,加热温度大于90℃,部分草酸发生分解,消耗高锰酸钾溶液的体积减少,会导致测得产品纯度偏高;
解答 解:(1)熔融固体物质需要再坩埚内加热,加热熔融物含有碱性KOH应用铁坩埚、铁棒、坩埚钳、泥三角、酒精灯,故答案为:c d;
(2)盐酸具有还原性,会被氧化,降低产品的量,故不宜用盐酸,
故答案为:盐酸具有还原性,会被氧化,降低产品的量;
(3)采用电解法时的阳极反应式,是锰酸根离子失电子生成高锰酸根离子,电极反应:MnO42--e-═MnO4-;与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率,
故答案为:MnO42--e-═MnO4-;K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率;
(4)③高锰酸钾与草酸钠发生氧化还原反应,反应的离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,反应中Mn2+浓度发生显著变化,应是反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好,加热温度大于90℃,部分草酸发生分解,消耗高锰酸钾溶液的体积减少,会导致测得产品纯度偏高,
故答案为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快;偏高.
点评 本题考查氧化还原反应离子方程式的书写、氧化还原反应滴定等,难度中等,注意把握实验的原理,需要学生具备一定的理论分析能力和计算解决问题的能力.


科目:高中化学 来源: 题型:多选题
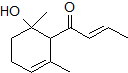 ,可用于制作香水.有关该化合物的下列说法正确的是( )
,可用于制作香水.有关该化合物的下列说法正确的是( )| A. | 分子式为C12H20O2 | B. | 该化合物可使酸性KMnO4溶液褪色 | ||
| C. | 该化合物可与NaOH溶液发生反应 | D. | 1 mol该化合物可与2 mol Br2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①②④ | C. | ①②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com