
| A、分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| B、在熔融状态下,lmol NaHSO4完全电离出的阳离子数为2NA |
| C、5.6 g铁粉在2.24L(标准状况)氯气中充分燃烧,失去的电子数为0.3NA |
| D、78g Na2O2固体与H2O完全反应转移的电子数为NA |
| m |
| M |
| V |
| Vm |
| m |
| M |
| 5.6g |
| 56g/mol |
| V |
| Vm |
| 2.24L |
| 22.4L/mol |
| m |
| M |
| 78g |
| 78g/mol |


科目:高中化学 来源: 题型:
| A、混合溶液的pH=7 | ||
B、若混合溶液中c(H+)=
| ||
| C、若混合溶液pH=4,则水电离出的c(H+)=1.0×10-10mol?L-1 | ||
| D、若HA为强酸,则混合后溶液中各离子浓度的大小关系一定为:c(A-)>c(B+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
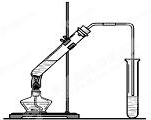 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、一定浓度的盐酸 | 饱和Na2CO3溶液 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在H2O2溶液中加入少量MnO2粉末 |
| B、镀锌铁皮加入足量的NaOH溶液中 |
| C、1mol铜片与含2mol H2SO4的浓硫酸共热 |
| D、常温下,1mol铜片投入含4mol HNO3的浓硝酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、基态原子第四电子层只有2个电子,则该原子第三电子层的电子数肯定为8或18个 | ||
| B、Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be | ||
C、R为第二周期元素,其原子具有的电子层数为最外层电子数的
| ||
| D、核外电子数为奇数的基态原子,其原子轨道中一定含有未成对电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com