
(1)若要配制100mL0.1mol•L﹣1Na2SO4溶液,需称量Na2SO4的质量为1.4g.
(2)将2240mL氨完全溶于水配成100mL溶液,氨水中NH3的物质的量浓度为1mol•L﹣1.(不考虑NH3与H2O的反应)
(3)实验室里常用固体氯化铵与足量熟石灰加热制取氨.若需要2240mL(标准状况)氨,求至少需要氯化铵的质量.
考点: 物质的量浓度的相关计算;化学方程式的有关计算.
专题: 计算题.
分析: (1)根据n=cV计算硫酸钠的物质的量,再根据m=nM计算需要硫酸钠的质量;
(2)氨水溶质为氨气,根据n=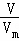 计算氨气的物质的量,再根据c=
计算氨气的物质的量,再根据c=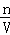 计算氨水的物质的量浓度;
计算氨水的物质的量浓度;
(3)令需要氯化铵的质量为mg,根据方程式2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O计算.
CaCl2+2NH3↑+2H2O计算.
解答: 解:(1)配制100mL0.1mol•L﹣1Na2SO4溶液,需称量Na2SO4的质量为:0.1L×0.1mol/L×142g/mol≈1.4g,故答案为:1.4;
(2)2240mL氨气的物质的量为: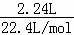 =0.1mol,
=0.1mol,
氨水的物质的量浓度为: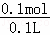 =1mol/L,
=1mol/L,
故答案为:1;
(3)令生成2240mL(标准状况)氨气需要氯化铵的质量为mg,则:
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
107g 44.8L
mg 2.24L
所以107g:mg=44.8L:2.24L
解得:m=5.35
答:需要氯化铵5.35g.
点评: 本题考查常用化学计量的有关计算、根据方程式的计算等,比较基础,注意基础知识的理解掌握.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒,已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.下列说法正确的是()
A. NaNO2在反应中被氧化
B. NaI是还原产物
C. 若反应过程中转移2mole﹣,则生成标准状况下NO的体积为44.8L
D. 氧化剂与还原剂之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
某盐的混合物中含有0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L Cl﹣,则SO42﹣为()
A. 0.1 mol/L B. 0.2 mol/L C. 0.3 mol/L D. 0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)﹣空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%﹣30%的KOH溶液.电池总反应为:N2H4+O2=N2↑+2H2O.下列关于该燃料电池工作时的说法正确的是()
A. 电池工作时,负极附近溶液的碱性增强
B. 正极的电极反应式是:O2+4H++4e﹣=2H2O
C. 负极的电极反应式是:N2H4+4OH﹣﹣4e﹣=4H2O+N2↑
D. 溶液中阴离子向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中每种物质都既有离子键又有共价键的一组是()
A. NaOH、H2SO4、(NH4)2SO4 B. MgO、Na2SO4、HNO3
C. Na2O2、KOH、Na3PO4 D. HCl、Fe2O3、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色)═N2O4(g) (无色),如图所示.
(1)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18mol/(L•min),乙中v(N2O4)=0.2mol/(L•s),则乙中反应更快.
(2)在0到1min中内用X表示该反应的速率是 ,该反应达限度时,Y的转化率60%,反应开始时与反应达平衡状态时的压强之比为 .
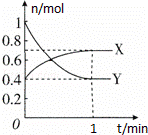
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com