
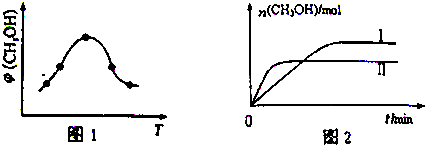
分析 (1)根据盖斯定律构造目标热化学方程式计算反应热;
(2)①平衡常数等于生成物的浓度系数次幂之积除以反应物浓度系数次幂之积;
②根据温度对平衡移动的影响判断反应热的符号;
③曲线Ⅱ到达平衡所用时间较短,则该条件下温度高,升高温度平衡逆移;
(3)根据反应物、反应条件、生成物写出化学反应式,然后利用三段式法计算.
解答 解:(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
依据盖斯定律,①-②×3得Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),故△H=489.0kJmol-1-3×172.5kJmol-1=-28.5kJmol-1,
故答案为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1;
(2)①二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),其平衡常数为:K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$,
故答案为:$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$;
②根据图象可知达到平衡后,温度越高,甲醇的体积分数φ(CH3OH)越小,说明升高温度平衡逆移,则正反应方向为放热反应,则△H<0,
故答案为:<;
③根据图象可知曲线Ⅱ到达平衡所用时间较短,则该条件下温度高,升高温度平衡逆移,平衡常数减小,则曲线Ⅱ条件下平衡常数较小,即KⅠ>KⅡ;
故答案为:>;
(3)根据反应物是二氧化碳和氨气(NH3),反应条件是高温、高压,生成物是尿素[CO(NH2)2]和水,化学反应式为:2NH3+CO2?CO(NH2)2+H2O,
设CO2的初始物质的量为a,则NH3的初始物质的量为3a,
2NH3+CO2?CO(NH2)2+H2O
起始/mol 3a a
转化/mol 1.2a 0.6a
平衡/mol 1.8a 0.4a
平衡时NH3转化率为:$\frac{1.2a}{3a}$×100%=40%,
故答案为:40%.
点评 本题考查了化学平衡的计算、盖斯定律的应用等知识,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的分析能力及化学计算能力.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的△H>0 | B. | 达平衡时,3v(H2)正=v(CO2)逆 | ||
| C. | a点对应的H2的平衡转化率为90% | D. | b点对应的平衡常数K值大于c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 温度(°C) | 起始浓度(mol•L-1) | 平衡浓度(mol•L-1) | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | ||
| ① | T | 1 | 3 | 0 | 0.2 | 1.4 | 0.8 |
| ② | T | 1.5 | 4.6 | 0.1 | b1 | b2 | b3 |
| ③ | T+30 | 1 | 3 | 0 | 0.25 | 1.5 | 0.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
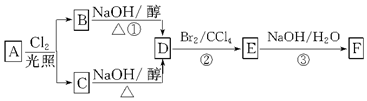
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
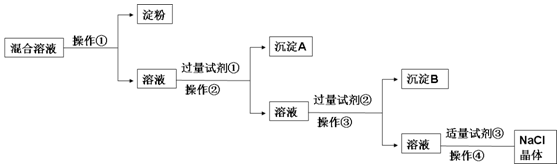
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | Na2O+H2O=2NaOH | ||
| C. | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | D. | 4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com