
下列说法中正确的是
A.胶体中分散质粒子直径小于1×10-9m
B.区别胶体与溶液的最简单的方法是丁达尔效应
C.往NaOH溶液中滴入FeCl3溶液立即可制得胶体
D.清晨的阳光穿过茂密的树木枝叶所产生的美丽景象(美丽的光线)是由于胶体粒子对光线的反射形成的
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列关于某些离子检验的方法,其中说法正确的是
A.向某溶液中加稀盐酸,将产生的无色无味的气体通入过量的澄清石灰水中,石灰水变浑浊,则原溶液中一定存在CO32-或HCO3-
B.向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定存在SO42-
C.向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润的蓝色石蕊试纸变红,则原溶液中一定存在NH4+
D.向某溶液中加入硝酸银溶液产生白色沉淀,再加稀盐酸,沉淀不消失,则原溶液中一定存在Cl-
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上月考二化学试卷(解析版) 题型:选择题
下列实验现象预测正确的是

A.实验I:振荡后静置,上层溶液颜色保持不变
B.实验II:酸性KMnO4溶液中无明显现象
C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上月考二化学试卷(解析版) 题型:选择题
根据有机化合物的命名原则,下列命名正确的是
A. 3﹣甲基﹣1,3﹣丁二烯
3﹣甲基﹣1,3﹣丁二烯
B. 2﹣羟基丁烷
2﹣羟基丁烷
C.CH3CH(C2H5)CH2CH2CH3 2﹣乙基戊烷
D.CH3CH(NH2)CH2COOH 3﹣氨基丁酸
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟一化学试卷(解析版) 题型:实验题
[Cu(NH3)4]SO4·H2O是一种重要的染料及合成农药中间体,受热可分解。某化学课外小组设计了如下实验(部分夹持装置略)验证它的部分分解产物,请回答问题:
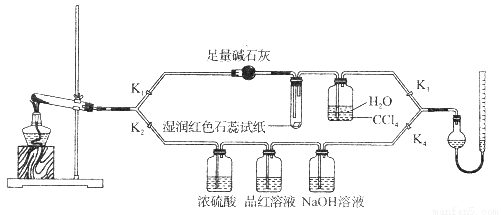
(1)连接装置,_________________________,在各装置中加入相应的药品和试剂。
(2)打开K2、K4,闭合K1、K3,加热一段时间后观察到品红溶液褪色,写出NaOH溶液中发生反应的离子方程式_____________________。
(3)打开K1、K3,闭合K2、K4,继续加热一段时间后观察到湿润红色石蕊试纸变蓝,证明分解产物中含有________________(填化学式)。
(4)CCl4的作用是__________________。
(5)加热过程中,还生成Cu、N2和H2O。写出[Cu(NH3)4]SO4·H2O分解的化学方程式________________。
(6)若实验中称取a g [Cu(NH3)4]SO4 · H2O,收集到b mL N2(已换算成标准状况),[Cu(NH3)4]SO4·H2O的分解率表达式为_______________。
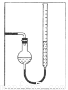
(7)量气管读数时需注意的事项有:①气体冷却到室温;②量气装置两侧液面相平;③______________。若某同学按右图所示读数,则计算出的分解率_______________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟一化学试卷(解析版) 题型:选择题
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )
A.V=44.8
B.原样品中Fe元素的质量分数为38.89%
C.滤液A中的阳离子为Fe 2+、Fe3+、H+
2+、Fe3+、H+
D.样品中CuO的质量为4.0 g
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟二化学试卷(解析版) 题型:实验题
实验室用如图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.
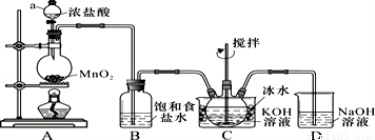
已知:K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定.
【制备KClO及K2FeO4】
(1)装置C中三颈瓶置于冰水浴中的目的是 .
(2)C中得到足量KClO后将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度 为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 .再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.
为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 .再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.
(3)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,
② ,
③ ,
④搅拌、静置、过滤,用乙醇洗涤2~3次,用乙醇洗涤的理由_____________ .
⑤在真空干燥箱中干燥.
【测定产品纯度】
(4)称取提纯后的K2FeO4样品0.2100 g于烧杯中,加入强碱性亚铬酸盐溶液,发生的反应为:Cr(OH)4﹣+FeO42﹣═Fe(OH)3↓+CrO42﹣+OH﹣;过滤后再加稀硫酸调节溶液呈强酸性,此时反应的离子方程式为: .
(5)将(4)反应后的溶液配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL.滴定时发生的离子反应为: .计算该K2FeO4样品的纯度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(SO42-)=C(Na+)>C(NH4+)>C(OH-)>C(H+) | B. | C(Na+)>C(SO42-)>C(NH4+)>C(OH-)>C(H+) | ||
| C. | C(NH4+)>C(SO42-)=C(Na+)>C(H+)>C(OH-) | D. | C(H+)+C(NH4+)+C(Na+)=C(OH-)+2C(SO42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com