
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB-![]() H++B2-在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是( )
H++B2-在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是( )
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】工业制硫酸的反应原理主要有下列三个反应:
①FeS2(s)+O2(g)![]() Fe2O3(s)+SO2(g);ΔH1
Fe2O3(s)+SO2(g);ΔH1
②2SO2(g)+O2(g)![]() 2SO3(g); ΔH2
2SO3(g); ΔH2
③SO3+H2O=H2SO4
Ⅰ.(1)反应①配平后各物质系数分别为_____、______、_______、______。若每生成1molSO2时反应放热426.5kJ,则ΔH1=_______________。
(2)工业生产中将FeS2矿石粉碎后投入反应器中反应,这样做的目的是___________。
Ⅱ.下表是不同温度和压强下反应②中SO2的转化率
0.1Mp | 0.5Mp | 1Mp | 10Mp | |
400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
600℃ | 73.7 | 85.8 | 89.5 | 96.4 |
(3)反应②是气体体积缩小的可逆反应,增大压强有利于提高原料转化率,但工业生产中该反应在常压下进行,采用常压生产条件的理由是_______________________。
(4)若原料气组成:SO2 7%,O211%,N2 82%,在温度和压强不变的条件下,混合气体体积变为原来的97.2%,则SO2的转化率为_________。
Ⅲ.尾气中的二氧化硫对环境造成污染,需要处理后才能排放。常用亚硫酸钠吸收法。
(5)Na2SO3溶液吸收SO2的离子方程式为________________________ ;
(6)常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
A.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)=c(SO32-)+c(HSO3-)+C(H2SO3)
C.c(Na+)>c(SO32-)>c(OH-)>c(H+)
D.水电离出c(OH-)=l×l0-8 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是

A. 反应过程中能量关系可用上图表示
B. ΔH的值与反应方程式的计量系数有关
C. 若将该反应设计成原电池,锌为负极
D. 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在NH4+和[Cu(NH3)4]2+中都存在配位键
B.  σ键和π键比例为7:1
σ键和π键比例为7:1
C. ![]() 与
与![]() 互为等电子体,1 mol
互为等电子体,1 mol ![]() 中含有的π键数目为2NA
中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l) = 3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中微粒浓度关系一定正确的是( )
A.0.1mol·L-1Na2CO3溶液中,加水稀释,![]() 的值减小
的值减小
B.0.1mol·L-1的硫酸铝溶液中:c(SO42-)>c(Al3+)>c(H+)>c(OH-)
C.pH=7的氨水与氯化铵的混合溶液中:c(Cl-)>c(NH4+)
D.pH=2的醋酸溶液和pH=12的NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=lgc(Ba2+),p(SO42)=lgc(SO42)。下列说法正确的是

A. 该温度下,Ksp(BaSO4)=1.0×1024
B. 加入BaCl2可以使溶液由c点变到a点
C. d点表示的是该温度下BaSO4的不饱和溶液
D. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为_________________。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________(选填序号,下同)。
a.配位键 b.氢键 c.金属键 d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________,该原子团中![]() 键与
键与![]() 个数的比值为___________________。
个数的比值为___________________。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:_______________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
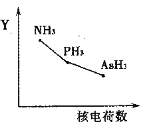
a.稳定性 b.沸点 c.R—H键能 d.分子间作用力
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______。
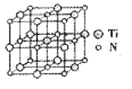
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2 (g)+B2 (g)=2AB (g)的能量变化如图所示,下列叙述正确的是

A. 该反应每生成2分子AB吸收(a-b)kJ能量
B. 该反应中反应物的总能量高于生成物的总能量
C. 该反应的反应热ΔH=+(a-b) kJ·mol-1
D. 断裂1molA-A键和1molB-B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiIFePO4)电池(如图所示)是新能源汽车的动力电池之一。M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池的总反应为LixC6+Li1-xFePO4![]() LiFePO4+6C。下列说法正确的是
LiFePO4+6C。下列说法正确的是
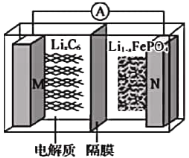
A. 放电时,Li+向M电极移动
B. 充电时电路中每通过0.5mol电子,就有36g碳和金属锂复合在一起
C. 放电时,M电极的电极反应为![]()
D. 充电时,N电极的电极反应为LiFePO4-xe-=xLi++Li1-xFePO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com