
����Ŀ����ӦFe��H2SO4===FeSO4��H2���������仯��������ͼ��ʾ��

(1)�÷�ӦΪ________��Ӧ(����ȡ����ȡ�)��
(2)��Ҫʹ�÷�Ӧ�ķ�Ӧ���ʼӿ죬���д�ʩ���е���__________(����ĸ)��
A������ƬΪ���� B����ϡ����Ϊ98%��Ũ���� C�������¶�
(3)����������Ӧ��Ƴ�ԭ��أ�ͭΪԭ���ijһ�����ϣ���ͭΪ________��(���������)��ͭ�缫�ϲ���������Ϊ____________���ü��Ϸ����ĵ缫��ӦΪ____________________�����·�е�����____________��(�������������ͬ)��________���ƶ���
���𰸡� ���� AC �� ������ɫ���� 2H����2e��===H2�� �� ��
�����������������(1)����ͼ���֪��Ӧ���������������������������(2)����Ӱ�췴Ӧ���ʵ����ط���ʹ�÷�Ӧ�ķ�Ӧ���ʼӿ�ķ�����(3)����ԭ��ظ�������������Ӧ������������ԭ��Ӧ�ж��������������ܷ�Ӧд�������ĵ缫��Ӧ�������и�������������
������(1) ��Ӧ������������������������������Ը÷�ӦΪ���ȷ�Ӧ��
(2)A������ƬΪ���ۣ�����Ӵ��������Ӧ���ʼӿ죬��A��ȷ����ϡ����Ϊ98%��Ũ���ᣬ�������ۻ�����B���������¶ȣ�����һ������C��ȷ��
(3)�����ܷ�Ӧ����ʽ��������������Ӧ����Ϊ��������ͭΪ������������ӦΪ![]() ��������ӦΪ
��������ӦΪ![]() �� ����ͭ�缫�ϲ���������Ϊ������ɫ���ݣ����·�е����ɸ��������ƶ���
�� ����ͭ�缫�ϲ���������Ϊ������ɫ���ݣ����·�е����ɸ��������ƶ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ˮ�ۺ����õĹ�ҵ����ͼ���ж�����˵����ȷ���ǣ� ��
��֪��MgCl2��6H2O��������Mg(OH)Cl��HCl����ȡ�
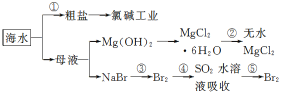
A����ȥ���������ʣ�Mg2+��SO42����Ca2+���������ҩƷ˳��Ϊ��NaOH��Һ��Na2CO3��Һ��BaCl2��Һ�����˺������
B���ڹ������н�MgCl2��6H2O���ռ����Ƶ���ˮMgCl2
C��������ת���Ƕ��������ȼҵ�еĵ�ⱥ��ʳ��ˮ��һ������ѧ��ת��Ϊ���ܵĹ���
D���ӵ���������������Ŀ����Ϊ����ȡ���ᴿBr2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z����Ԫ�ص�ԭ������֮�͵���42��XԪ��ԭ�ӵ�4p�������3��δ�ɶԵ��ӣ�YԪ��ԭ�ӵ������2p�������2��δ�ɶԵ��ӡ�X��Y���γɻ�����X2Y3��ZԪ�ؿ����γɸ�һ�����ӡ���ش��������⣺
(1)XԪ��ԭ�ӵĻ�̬�����Ų�ʽΪ ����Ԫ�صķ����� ��
(2)YԪ��ԭ�ӵļ۲���ӵĵ����Ų�ͼΪ ����Ԫ�ص������� ��
(3)X��Z���γɻ�����XZ3���û�����Ŀռ乹��Ϊ ��
(4)�Ƚ�X���⻯����ͬ��ڶ���������Ԫ�����γɵ��⻯����ȶ���˳��(�ɴ�С) ���е�˳��(�ɸߵ���) ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4NH3(g)��5O2(g)![]() 4NO(g)��6H2O(g)����5 L�ܱ������н��У�����Ӻ�NO�����ʵ���������0.3 mol����˷�Ӧ��ƽ������Ϊ(����)
4NO(g)��6H2O(g)����5 L�ܱ������н��У�����Ӻ�NO�����ʵ���������0.3 mol����˷�Ӧ��ƽ������Ϊ(����)
A. v(O2)��0.01 mol/(L��s) B. v(NO)��0.008 mol/(L��s)
C. v(H2O)��0.003 mol/(L��s) D. v(NH3)��0.004 mol/(L��s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����һ�����£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3CH3COO��+H+ ��H��0 �����з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶�������� ��
CH3CH3COO��+H+ ��H��0 �����з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶�������� ��
a����������0.10mol��L��1��ϡ����
b������
c����ˮϡ����0.010mol��L��1
d����������������
e�����������Ȼ��ƹ���
f����������0.10mol��L��1��NaOH��Һ
��2�������ʵ���Ũ�ȵ��������ʵ���Һ����NaCl��CH3COONa ��NH4Cl ��AlCl3 ��Ba(OH)2 ��Na2CO3��NaHCO3��NaHSO4��NaOH ��H2SO4��pHֵ�ɴ�С��˳���ǣ�����ţ� ��
��3�����������Լ�����̪��ʯ�ϡ���ᡢCH3COONa���塢Ũ���ᡢCa(OH)2��ĩ��CH3COONH4���������ˮ�����ݣ���������ˮ�д��ڵ���ƽ�⣻������������ӻ��ƻ�ˮ�ĵ���ƽ�⡣������ƽ����ƶ���������ָʾ����ɫ�ı仯���ɴ˿ɷֱ�ѡ�������Լ����������ʵ��֤��CH3COOH�����ᣬ�����ʵ�鷽��������
��Ӧ�ø�������ʵ�鷽�������� ��
��Ӧ�ø�������ʵ�鷽�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��25mL 0.1 mol��L-1 NaOH��Һ����εμ�0.2 mol��L-1CH3COOH��Һ��������ҺpH�ı仯���ߡ�AB���䣬c(OH��)��c(H+)����c(OH��)��c(CH3COO��)��С��ϵ��

A��c(OH��)һ������c(CH3COO��) B��c(OH��)һ��С��c(CH3COO��)
C��c(OH��)һ������c(CH3COO��) D��c(OH��)���ڡ�С�ڻ����c(CH3COO��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ���Ӧ��N2��3H2![]() 2NH3��һ�����ȵĿ��淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�����
2NH3��һ�����ȵĿ��淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�����
(1)��֪1 mol N2��ȫ��Ӧ����NH3�ɷų�92kJ�����������1 mol N2��3 mol H2��ϣ�ʹ���ַ�Ӧ���ų���������С��������ֵ����ԭ����___________________________________��
(2)ʵ����ģ�ҵ�ϳɰ�ʱ�����ݻ�Ϊ2 L���ܱ������ڣ���Ӧ����10 min������10 mol NH3������N2��ʾ�Ļ�ѧ��Ӧ����Ϊ_______________��
(3)һ�������£����ϳɰ��ķ�Ӧ�ﵽ��ѧƽ��ʱ������˵����ȷ����_____________��
a������Ӧ���ʺ��淴Ӧ������� b������Ӧ��������淴Ӧ����Ϊ0
c���������£�N2��ת���ʴﵽ���ֵ d��N2��H2��Ũ�����
e��N2��H2��NH3������������ f������ʱ��ϵѹǿ���ֲ���
��4�����ĸ���ͬ�����У���ͬ�����½��кϳɰ���Ӧ����������ͬʱ���ڲⶨ�Ľ�����жϸ÷�Ӧ�������ɴ�С��˳����__________________________���ñ����д����
A��V(NH3)=0.5 mol L-1-min-1 B��V(H2)=0.3 mol L-1-min-1
C��V(N2)=0.2 mol L-1-min-1 D��V(H2)=0.01 mol L-1- s -1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I2��KI��Һ�д�������ƽ�⣺I2��aq��+I����aq��![]() I3����aq����ijI2��KI�����Һ�У�c��I3�������¶�T�Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵����ȷ���ǣ� ��
I3����aq����ijI2��KI�����Һ�У�c��I3�������¶�T�Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵����ȷ���ǣ� ��

A����Ӧ I2��aq��+I����aq��![]() I3����aq����H��0
I3����aq����H��0
B�����¶�ΪT1��T2����Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2����K2��K1
C����T1ʱ����Ӧ���е�״̬dʱ��һ���Ц���������
D��״̬a��״̬b��ȣ�״̬bʱI2��ת���ʸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ѧ��Ӧ������������ѧ��Ӧ���п����̶ȵ�����������ͼ��ijͬѧ����ϡ�������������ƣ�Na2S2O3���ķ�Ӧ���ⶨ��ѧ��Ӧ���ʲ�̽����Ӱ�����ص�ʵ�顣

��.�ⶨ��ѧ��Ӧ���ʣ���֪��S2O![]() ��2H�� === H2O��S����SO2��
��2H�� === H2O��S����SO2��
�� ����ͼװ����ʾ��ʵ����Ʒ�⣬����Ҫ��һ��ʵ����Ʒ��__________��
�� ����2 minʱ�ռ���224 mL(��״����)���壬�ɼ������2 min��H���ķ�Ӧ���ʣ����òⶨֵ��ʵ��ֵƫС����ԭ����_____________________��
�� ���øû�ѧ��Ӧ���Լ���һ�ֲⶨ��Ӧ���ʵ�����������_______________��
��.̽����ѧ��Ӧ���ʵ�Ӱ�����أ���֪ I2��2S2O32- === S4O62- ��2I��
Ϊ̽�ַ�Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��Ƶ�ʵ�鷽�����±���
(��֪Na2S2O3��Һ����)
ʵ����� | ���V/mL | ʱ��/s | |||
Na2S2O3��Һ | ������Һ | ��ˮ | ˮ | ||
�� | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
�� | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
�� | 6.0 | 2.0 | 4.0 | V | t3 |
�� ����V ��__________mL��t1��t2��t3�Ĵ�С��ϵ��____________________________��
( 2 ) ���������£�������̶����ܱ������У�������ӦX��g��+3Y��g��![]() 2Z��g������X��Y��Z��ʼŨ�ȷֱ�Ϊc1��c2��c3������Ϊ0����ƽ��ʱX��Y��Z��Ũ�ȷֱ�Ϊ0.1molL��1��0.3molL��1��0.08molL��1��
2Z��g������X��Y��Z��ʼŨ�ȷֱ�Ϊc1��c2��c3������Ϊ0����ƽ��ʱX��Y��Z��Ũ�ȷֱ�Ϊ0.1molL��1��0.3molL��1��0.08molL��1��
��ش��������⣺
�� c1+c2+c3��ȡֵ��ΧΪ____________________
�� c1��c2��ֵΪ__________________ ������������֤���÷�Ӧ�Ѵﵽ��ѧƽ��״̬���� __________ A.��������ܶȲ��ٱ仯 B.v����X��=2 v����Z�� C.������ѹǿ���ٷ����仯 D.��������ƽ����Է������� E. X�����ʵ�����Y�����ʵ���֮��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com