
| A、气态氢化物的稳定性:HnX 强于HmY |
| B、X和Y形成化合物时,X显负价,Y显正价 |
| C、第一电离能一定是:Y小于X |
| D、最高价含氧酸的酸性:X>Y |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格:
实验室制得气体中常含有杂质,影响其性质检验.如图A为除杂装置,B为性质检验装置,完成下列表格:| 序号 | 气体 | 反应原理 | A中试剂 |
| ① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | |
| ② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是 | NaOH溶液 |
| ③ | 乙炔 | 电石与饱和食盐水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 验证氧化性 | ||
| 验证不稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
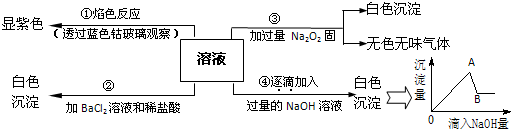
查看答案和解析>>
科目:高中化学 来源: 题型:
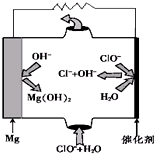 硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在.
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在.| 温度(℃) | 527 | 758 | 927 |
| 平衡常数 | 784 | 1.0 | 0.04 |
查看答案和解析>>
科目:高中化学 来源: 题型:
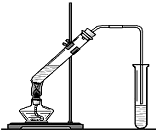 (1)装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
(1)装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com