
| A. | 钠在空气和氯气中燃烧,火馅皆呈黄色,但生成固体的颜色不同 | |
| B. | 新制饱和氯水和浓硝酸在光照下会有气体产生,其成分中有氧气 | |
| C. | 亚硫酸露置在空气中酸性减弱 | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为瓷坩埚中的SiO2能与NaOH反应 |
分析 A.钠元素焰色反应为黄色;钠在空气中燃烧生成淡黄色固体过氧化钠,在氯气中燃烧生成白色固体氯化钠;
B.新制的氯水光照时,氯水中次氯酸分解生成HCl和氧气;浓硝酸在光照条件下分解生成二氧化氮、氧气和水;
C.亚硫酸不稳定,易被空气氧化生成硫酸;
D.二氧化硅是酸性氧化物,能和NaOH反应生成硅酸钠和水.
解答 解:A.钠元素焰色反应为黄色;钠在空气中燃烧生成淡黄色固体过氧化钠,在氯气中燃烧生成白色固体氯化钠,所以火焰颜色相同,但产物颜色不同,故A正确;
B.新制的氯水光照时,氯水中次氯酸分解生成HCl和氧气;浓硝酸在光照条件下分解生成二氧化氮、氧气和水,所以两种物质得到的气体都是氧气,故B正确;
C.亚硫酸不稳定,易被空气氧化生成硫酸,亚硫酸是弱酸、硫酸是强酸,所以导致溶液的pH减小,酸性增强,故C错误;
D.二氧化硅是酸性氧化物,能和NaOH反应生成硅酸钠和水,所以灼烧NaOH固体时不能使用瓷坩埚,故D正确;
故选C.
点评 本题考查元素化合物性质,为高频考点,侧重考查学生分析判断能力及对知识的掌握,明确元素化合物性质及物质之间的反应是解本题关键,易错选项是C.


科目:高中化学 来源: 题型:填空题
 烧杯中盛有NaHSO4和Na2SO4混合溶液体积为100mL,向烧杯中逐滴加入0.15mol•L-1Ba(OH)2溶液,当沉淀量达到最大值时,溶液的总体积为200mL.溶液中产生沉淀的物质的量n与溶液的pH的变化如图所示.请回答:
烧杯中盛有NaHSO4和Na2SO4混合溶液体积为100mL,向烧杯中逐滴加入0.15mol•L-1Ba(OH)2溶液,当沉淀量达到最大值时,溶液的总体积为200mL.溶液中产生沉淀的物质的量n与溶液的pH的变化如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃ |
| A. | 含有金属阳离子的晶体不一定是离子晶体 | |
| B. | 同族元素的氧化物可形成不同类型的晶体 | |
| C. | 活泼金属元素与活泼非金属元素一定能形成离子化合物 | |
| D. | 金属晶体的熔点不一定比分子晶体的高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能与氢气发生加成反应 | B. | 葡萄糖能发生氧化反应和水解反应 | ||
| C. | 淀粉水解的最终产物是葡萄糖 | D. | 蛋白质遇浓硫酸变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
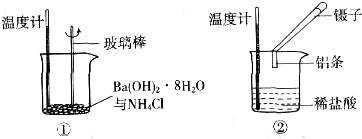
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡C-CH2CH3 | B. | CH3C≡CH | C. | CH3CH2CH═CH2 | D. | CH2═CH-CH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

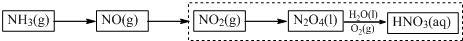

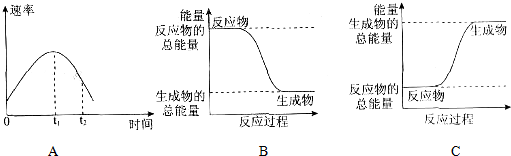
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴0.1mol/L FeCl3溶液 | ①白色沉淀转化为红褐色沉淀 |
| Ⅱ | 4mL 2 mol/L NH4Cl 溶液 | ②白色沉淀溶解,得无色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融态的Al2O3、12C转化为14C都属于化学变化 | |
| B. | Cu2(OH)2CO3、冰水混合物、四氧化三铁都不是混合物 | |
| C. | 葡萄糖溶液和淀粉溶液两种分散系的本质区别是能否产生丁达尔效应 | |
| D. | SiO2、NO2、CO2都属于酸性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com