
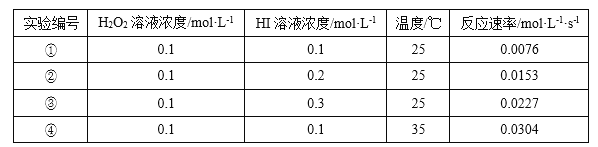
【题目】某校化学兴趣小组根据反应 H2O2+2HI=2H2O+I2 探究影响化学反应速率的因素。实验数据如下
回答下列问题:
(1)反应 H2O2+2HI=2H2O+I2 中,氧化剂是_____。
(2)25℃时,表明增大反应物浓度,化学反应速率_____(填“增大”成“减小”)。
(3)能表明温度对化学反应速率影响的实验编号是①和_____。
(4)H2O2 不稳定,写出 H2O2 发生分解反应的化学方程式:_____。
【答案】H2O2 增大 ④ 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
【解析】
(1)得到电子化合价降低的是氧化剂;
(2)根据浓度对反应速率的影响分析解答;
(3)探究温度对反应速率的影响,其它条件不变;
(4)双氧水分解生成氧气和水,据此书写。
(1)反应H2O2+2HI=2H2O+I2中氧元素化合价降低,得到电子发生还原反应,氧化剂是H2O2。
(2)根据表中数据可知25℃时,增大反应物浓度,化学反应速率增大。
(3)要探究温度对反应速率的影响,其它条件不变,因此根据表中数据可知能表明温度对化学反应速率影响的实验编号是①和④。
(4)H2O2不稳定易分解生成氧气和水,则H2O2发生分解反应的化学方程式为2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。


科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予美国科学家约翰古迪纳夫、斯坦利惠廷厄姆和日本科学家吉野彰,以表彰他们在锂离子电池研发领域作出的贡献。近日,有化学家描绘出了一种使用DMSO(二甲亚砜)作为电解液,并用多孔的黄金作为电极的锂—空气电池的实验模型,该电池放电时在多孔的黄金上氧分子与锂离子反应,形成过氧化锂,其装置图如图所示。下列有关叙述正确的是( )

A.DMSO电解液能传递Li+和电子,不能换成水溶液
B.该电池放电时每消耗2molO2,转移4mol电子
C.给该锂—空气电池充电时,金属锂接电源的正极
D.多孔的黄金为电池正极,电极反应式可能为O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学生利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)

回答下列问题:
(1)所用铁粉中若有杂质,欲除去不纯铁粉中混有的铝粉可以选用的试剂为_____________(填序号)。
A.稀盐酸 B.氢氧化钠溶液 C.浓硫酸 D.FeCl3溶液
此步涉及反应的离子方程式为_____________________________________。
(2)反应发生后装置B中发生反应的化学方程式是______________________________。D装置的作用:________________________________________________。
(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
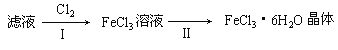
①用离子方程式表示步骤I中通入Cl2的作用__________________________________;
②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明。向一支装有该未 知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液。你认为此方案是否合理_______________(填“合理”或“不合理”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的2p电子数是2s电子数的一半,由Y、Z元素组成的某种化合物是一种常用的漂白剂、供氧剂,Z和R位于同周期且R的基态原子中有3个电子能量最高,M2+与过量氨水作用,先得到蓝色沉淀后转化为深蓝色溶液Q。请回答下列问题:
(1)Z、R、M三种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(2)XCl3、RCl3两种分子中属于非极性分子的是_______ (填化学式)。
(3)已知H2Y2和RH3的相对分子质量相同,H2Y2的熔点为-0.43℃,沸点为158℃,而RH3的熔点为-133℃,沸点为-87.7℃,其主要原因是_________。
(4)X、R元素可形成一种具有立体网状结构的化合物,其晶胞结构如图所示,该化合物的晶体类型是______,化学式为________,X的配位数是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中有NO2

C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3 具有热不稳定性
D. 充分反应后,锥形瓶内有 NO3-存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池已用于航天飞机,其工作原理如图所示。关于该燃料电池的说法不正确的是
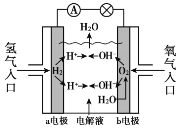
A. H2在负极发生氧化反应
B. 电子从a电极经外电路流向b电极
C. 供电时的总反应为:2H2 + O2 == 2H2O
D. 燃料电池的能量转化率可达100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案中均使用了NaCl溶液,能达到实验目的的是( )
编号 | A | B | C | D |
实验 方案 |
置于光亮处 |
|
片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
|
实验 目的 | 验证甲烷与氯气发生化学反应 | 进行喷泉实验 | 验证Fe电极被保护 | 验证乙炔的还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项实验基本操作中,正确的是
A. 为了加快锌和稀硫酸反应的速率,可以向稀硫酸中加入少量硫酸铜![]()
B. 在做中和滴定实验时清洗滴定管后,直接装液滴定
C. 为了加快过滤速度,用玻璃棒搅拌过滤器中的液体
D. 为了使配制的氯化铁溶液保持澄清,加入盐酸和铁片
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com