
【题目】铜是人类最早使用的金属之一。能形成多种化合物,易形成配位化合物。回答下列问题:
(1)Cu位于周期表第四周期第___族。写出其基态原子的电子排布式_____。
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子___.(填“多”“少”或“相等”)。
②第二电离能Cu比Ni高,原因是_____。
(3)Cu可以和EDA(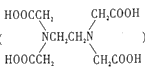 )形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
)形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为_____,O2中σ和![]() 健的个数比是______。
健的个数比是______。
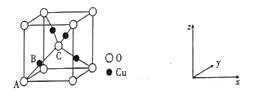
②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是(![]() ,
,![]() ,
,![]() ),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3
),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3
【答案】ⅠB 1s22s22p63s23p63d104s1 多 Cu+的价电子排布式为3d10,比Ni的稳定 sp2、sp3杂化 O、N、C V形 1∶1 (![]() ,
,![]() ,
,![]() )
) 
【解析】
(1)根据元素周期表,推出Cu位于周期表第四周期ⅠB族,其基态原子电子的排布式是1s22s22p63s23p63d104s1或[Ar] 3d104s1;
答案是ⅠB;1s22s22p63s23p63d104s1或[Ar] 3d104s1;
(2)①Ni和Cu相比,Ni的价电子排布式为3d84s2,Ni的基态原子有2个未成对电子,Cu的基态原子只有1个未成对电子,Ni基态原子中未成对电子多;
答案为多;
②Cu+的价电子排布式为3d10,处于全满,而Ni+的价电子排布式为3d84s1,因此Cu+第二电离能比Ni+的稳定;
答案是Cu+的价电子排布式为3d10,比Ni的稳定;
(3)EDTA中“-CH2”中C价层电子对数为4,即杂化类型为sp3,羧基中C的价层电子对数为3,即杂化类型为sp2;同周期从左向右电负性增强,即三种元素的电负性顺序是O>N>C;
答案是sp2、sp3杂化;O>N>C;
(4)①SO2中中心原子S有2个σ键,孤电子对数为![]() =1,即SO2的空间构型为V型;成键原子之间只能形成1个σ键,一般认为O2的结构式为O=O,其中含有一个个σ键和一个π键,即个数比为1:1;
=1,即SO2的空间构型为V型;成键原子之间只能形成1个σ键,一般认为O2的结构式为O=O,其中含有一个个σ键和一个π键,即个数比为1:1;
答案是V型;1:1;
②根据晶胞的结构,B点在A和C连线的中点,根据A和B的坐标,得出B原子的坐标为(![]() ,
,![]() ,
,![]() );根据晶胞的结构,Cu+全部位于晶胞内部,即Cu+个数为4,O2-位于顶点和内部,即O2-的个数为
);根据晶胞的结构,Cu+全部位于晶胞内部,即Cu+个数为4,O2-位于顶点和内部,即O2-的个数为![]() =2,化学式为Cu2O,该晶胞的质量为
=2,化学式为Cu2O,该晶胞的质量为![]() g,晶胞的边长为
g,晶胞的边长为![]() ,根据密度的定义,推出该晶胞的密度是
,根据密度的定义,推出该晶胞的密度是 g/cm3;
g/cm3;
答案是(![]() ,
,![]() ,
,![]() );
); g/cm3。
g/cm3。


 同步轻松练习系列答案
同步轻松练习系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数)
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1mol氦气含有的原子数为NA
C.71gCl2所含原子数为 NA
D.23g钠在化学反应中失去电子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、CO32-,SO42-,现取三份100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.08mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是
A.K+一定存在
B.100mL溶液中含0.01mol CO32-
C.Cl—一定存在
D.Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述中正确的是 ( )
A. pH=0的H2SO4溶液与1 mol·L-1 的Ba(OH)2溶液中水的电离程度相同
B. 0.2mol·L-1 CH3COOH溶液中的c(H+)是0.1mol·L-1 CH3COOH中的c(H+)的2倍
C. 室温时,pH=2的CH3COOH和0.01mol·L-1 NaOH溶液等体积混合,混合后pH=7
D. 等物质的量浓度的Na2S和NaHS的混合溶液中:2c(Na+)=3[c(S2-)+c(HS-)+c(H2S)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关说法正确的是
A. 60g冰醋酸晶体中,含阴离子数目为NA
B. 标准状况下,22.4LCCl4中含有分子的数目为NA
C. 常温下,46gNO2与N2O4混合气体中含分子数为NA
D. 32gCu投入300mL10mol/L的浓硝酸中,充分反应后转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒压绝热容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
A. 达到化学平衡状态时,v正(O2)=2v逆(SO2)
B. 容器内的压强不再变化说明反应达到化学平衡状态
C. 加入0.2 mol SO2和0.1 mol O2,充分反应后放出热量19.7kJ
D. 向容器中充入二氧化硫,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
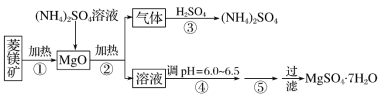
(1)步骤②中发生反应的离子方程式为__________________________________________。
(2)步骤④中调节pH=6.0~6.5的目的是_______________________________________。
(3)步骤⑤的操作为________________________________________________________。
(4)若要除去MgSO4溶液中的FeSO4应先加________,再加入过量__________,过滤即可把杂质除尽;请用离子方程式以及文字说明除杂原理___________________________________
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25 ℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为____________(已知25 ℃时 ,Ksp[Mg(OH)2]=5.6×10-12 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒的空间构型相同的是( )
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO44—和SO42—
A. 全部B. 除①④⑥以外C. ③④⑤⑥D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当1,3-丁二烯和溴单质1:1加成时,其反应机理及能量变化如下:
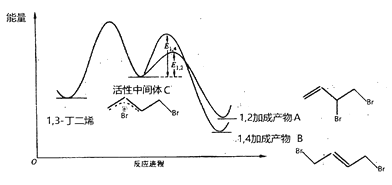
不同反应条件下,经过相同时间测得生成物组成如下表:
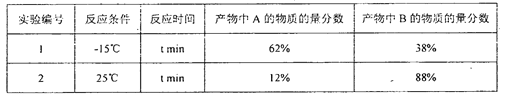
下列分析不合理的是
A. 产物A、B互为同分异构体,由中间体生成A、B的反应互相竞争
B. 相同条件下由活性中间体C生成产物A的速率更快
C. 实验1测定产物组成时,体系己达平衡状态
D. 实验1在t min时,若升高温度至25℃,部分产物A会经活性中间体C转化成产物B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com