
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
分析 ①含离子键的一定为离子化合物;
②离子化合物中可能均为非金属元素;
③离子化合物的熔点较高,但加热可能分解;
④离子化合物一定含离子键,可能含共价键.
解答 解:①含离子键的一定为离子化合物,则离子化合物一定是含有离子键的化合物,故正确;
②离子化合物中可能均为非金属元素,如铵盐中不含金属元素,故错误;
③离子化合物的熔点较高,但加热可能分解,如碳酸氢钠加热易分解,故错误;
④离子化合物一定含离子键,可能含共价键,如NaOH中含离子键、共价键,NaCl中只含离子键,故正确;
故选B.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
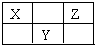 X、Y、Z三种短周期元素在周期表中的位置如图所示.若X的最高正价与负价的代数和为2,则下列说法正确是( )
X、Y、Z三种短周期元素在周期表中的位置如图所示.若X的最高正价与负价的代数和为2,则下列说法正确是( )| A. | 原子序数由大到小为 Z>Y>X | |
| B. | 氢化物最稳定的元素为Z | |
| C. | 最高价氧化物的水化物酸性最强的元素为Z | |
| D. | 原子半径由大到小为 Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第1列和第17列元素的单质熔沸点变化趋势相反 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第15列元素的最高价氧化物为R2O58 | |
| D. | 尚未发现的第113号元素在第七周期第13列 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ①② | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
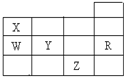 如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | 元素原子半径:W<Y | |
| B. | X、Y的阴离子电子层结构都与R原子相同 | |
| C. | Y元素的非金属性比W元素的非金属性强 | |
| D. | 常温常压下五种元素的单质中,Z单质的沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将盐酸的用量增加一倍 | B. | 盐酸的浓度增加一倍,用量减半 | ||
| C. | 温度升高30℃ | D. | 改用更小块的CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | a>b>c | B. | a>c>b | C. | a=b+m+n | D. | a=c-n-m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com