
分析 (1)该二元酸第一步完全电离,第二步部分电离,说明A2-能水解、HA-只电离不水解,Na2A水溶液中A2-水解导致溶液呈碱性;
(2)依据H2A═H++HA-、HA-?H++A2-,回答即可;
(3)根据溶液中的电荷守恒、物料守恒以及质子守恒来回答.
解答 解:(1)该二元酸第一步完全电离,第二步部分电离,说明A2-能水解、HA-只电离不水解,Na2A水溶液中A2-水解导致溶液呈碱性,水解方程式为A2-+H2O?HA-+OH-,故答案为:碱性;A2-+H2O?HA-+OH-;
(2)依据H2A═H++HA-判断,此二元酸的第一步电离是完全的,即HA-不水解,但是HA-存在电离:HA-?H++A2-,故NaHA溶液显酸性,即pH<7,
故答案为:小于;H2A第一步完全电离,HA-离子不发生水解,只发生电离溶液显酸性HA-?H++A2-;
(3)A、0.1mol/L的Na2A溶液中,根据A原子守恒,所以c(A2-)+c(HA-)+c(H2A)=0.1mol•L-1,故A正确;
B、在溶液中,根据质子守恒得:c(OH-)=c(H+)+c(HA-),故B正确;
C、0.1mol/L的Na2A溶液中,存在电荷守恒:c( Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故C正确;
D、由物料守恒可知c(Na+)=2c(A2-)+2c(HA-)+2c(H2A),故D错误,
故答案为:ABC.
点评 本题考查了弱电解质的电离、盐类水解等知识点,注意该二元酸两步电离的不同,HA-离子只电离不水解是解题关键,为易错点,题目难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料 | |
| B. | 将煤进行气法处理,提高煤的综合利用效率 | |
| C. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用观,即:减 少资源消耗、增加资源的重复使用、奖励资源的循环再生使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
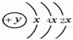 ,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.
,该位于周期表三周期IVA族;元素名称为硅,其最高价氧化物的化学式为SiO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
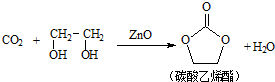
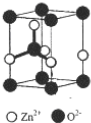
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W的最高正价与最低负价的代数和为6,下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W的最高正价与最低负价的代数和为6,下列判断正确的是( )| A. | 原子半径:rW>rZ>rY>rX | |
| B. | Y的氧化物是酸性氧化物,不与任何酸反应 | |
| C. | 最简单气态氢化物的热稳定性:H2W>ZH4 | |
| D. | X元素的非金属性比Y元素的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
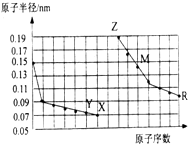
| A. | 简单离子的半径大小比较:Z>Y>X | |
| B. | 气态氢化物稳定性:Y>X>R | |
| C. | 单质的熔点:M>Z | |
| D. | Z单质能从M的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O的质量为18g/mol | B. | CH4的摩尔质量为16g | ||
| C. | 3.01×1023个SO2分子的质量为32g | D. | 标准状况下,1molH2O体积是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
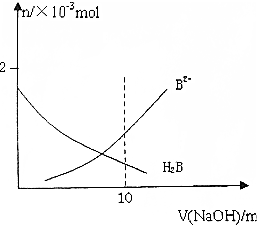 常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )
常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )| A. | 当V(NaOH)=10mL时,溶液中有关粒子浓度大小关系为:c(Na+)>c(B2-)>c(HB-)>c(H2B)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2B溶液混合后其溶液中,水的电离程度被促进 | |
| C. | 向NaHB溶液中加水稀释,溶液中c(Na+),c(B2-),c(HB-),c(OH-)均减小 | |
| D. | 当V(NaOH)=10mL时,溶液中存在下列关系c(H2B)+c(H+)=c(OH-)+c(B2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com