
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是:
A.向含有FeI2的溶液中通入适量氯气,当有1 mol Fe2+被氧化时,该反应转移电子数目为3NA
B.0.1 mol丙烯酸(CH2=CH—COOH)中含有双键数目为0.1NA
C.含0.1 mol NH4HSO4的溶液中,阳离子数目略小于0.2NA
D.2.0 g H2![]() O与D2O的混合物中所含中子数为NA
O与D2O的混合物中所含中子数为NA
【答案】D
【解析】
A.向含有FeI2的溶液中通入适量氯气,由于I-的还原性大于Fe2+,氯气先氧化I-,则当有1molFe2+被氧化时,溶液中的碘离子已经完全被氧化,而由于溶液中碘离子的个数未知,故反应转移的电子数无法计算,故A错误;
B.丙烯酸的结构简式为CH2=CH—COOH,丙烯酸中含碳碳双键和碳氧双键,故1mol丙烯酸中含2mol双键,即0.1mol丙烯酸中含有双键的数目为0.2NA,故B错误;
C.含0.1molNH4HSO4的溶液中含有0.1molSO42-,0.1molSO42-带有0.2mol负电荷,由于溶液中还含有氢氧根离子,则负电荷的总物质的量大于0.2mol,根据电荷守恒,溶液中正电荷的总物质的量一定大于0.2mol,溶液中阳离子为铵根离子、氢离子,都带1个单位正电荷,则溶液中含有阳离子数目略大于0.2NA,故C错误;
D.H218O与D2O的摩尔质量均为20g/mol,则2.0g混合物的物质的量为0.1mol,且两者均含10个中子,故0.1mol混合物中含NA个中子,故D正确;
答案为D。


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】(1)含苯酚的工业废水必须处理达标后才能排放,苯酚含量在1 g·L-1 以上的工业废水应回收苯酚。某研究性学习小组设计下列流程,探究废水中苯酚的回收方法。
![]()
①可用_______为试剂检验水样中是否含有苯酚。
②操作I的名称为_______,试剂a的化学式为_______。
③通入CO2发生反应生成苯酚的化学方程式为________。
(2)某有机物的分子式为C3H6O3。
①1 mol该有机物充分燃烧消耗的O2在标准状况下的体积为_________L。
②若两分子该有机物能生成六元环状结构,写出该反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用 R代表)。 回答下列问题:
(1)基态氮原子价层电子的轨道表示式为_____。
(2)氯离子的基态电子排布式为_____,有_____种不同能级的电子。
(3)R 中 H、N、O 三种元素的电负性由大到小的顺序是_____(用元素符号表示)。
(4)如图表示短周期元素 X 的基态原子失去电子数与对应电离能的关系,试推测 X 与R 中的_____(填元素符号)元素同周期。
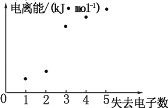
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于四种装置的叙述不正确的是( )
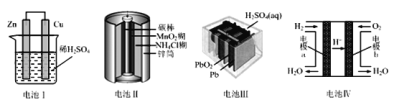
A.电池Ⅰ:正极发生的反应为2H++2e﹣═H2↑
B.电池Ⅱ:锌筒做负极,发生氧化反应
C.电池Ⅲ:是最早使用的充电电池,又称为二次电池
D.电池Ⅳ:外电路中电子由电极b通过导线流向电极a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
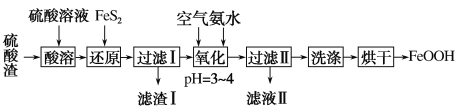
(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为___________________。
(2)滤渣I的主要成分是FeS2、S和___________(填化学式);Fe3+被FeS2还原的离子方程式为_______________。
(3)“氧化”中,生成FeOOH的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛分子结构式如图,用2个Cl取代甲醛中的H可得到碳酰氯,下列描述正确的是( )
![]()
A.甲醛分子和碳酰氯分子是等电子体
B.碳酰氯分子中的C原子为手性碳原子
C.甲醛分子中的H-C-H键角与碳酰氯分子中的Cl-C-Cl相等
D.碳酰氯分子为平面三角形,分子中存在有3个σ键、1个π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com