
| A. | Na2CO3 | B. | NaOH | C. | K2SO4 | D. | H2SO4 |
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 电池放电时,H2参与负极反应,发生氧化反应 | |
| B. | 电池放电时,镍元素被氧化 | |
| C. | 电池放电时,电子从氢气这一极到NiO(OH) 这一极 | |
| D. | 电池充电时,电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )
X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )| 选项 | X | Y | Z |
| A | Al | Al(OH)3 | Al2O3 |
| B | Na | Na2O2 | NaOH |
| C | H2SO3 | SO2 | H2SO4 |
| D | HCl | Cl2 | HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
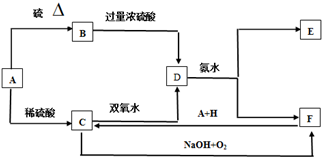
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
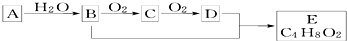
| A. | 鉴别A和甲烷可选择酸性高锰酸钾溶液 | |
| B. | B、D均能与金属钠反应 | |
| C. | 物质C的结构简式为CH3CHO | |
| D. | B+D→E的化学方程式为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com