
分析 (1)由反应可知,被还原的硝酸的物质的量等于气体的物质的量,结合n=$\frac{V}{Vm}$计算;
(2)铜与硝酸反应中,铜失电子作还原剂,硝酸得电子作氧化剂,结合电子守恒及原子守恒计算.
解答 解:(1)由反应可知,被还原的硝酸的物质的量等于气体的物质的量,为$\frac{4.48L}{22.4L/mol}$=0.2mol,
答:被还原的硝酸的物质的量为0.2mol;
(2)铜的物质的量为$\frac{12.8g}{64g/mol}$=0.2mol,则0.2molCu变成Cu2+失去的电子为0.2mol×2=0.4mol,
设生成NO的物质的量为xmol,NO2的物质的量为ymol,混合气体的物质的量为0.2mol,
由原子守恒及电子守恒可知,$\left\{\begin{array}{l}{x+y=0.2}\\{3x+y=0.2×2}\end{array}\right.$,解得x=0.1mol,y=0.1mol,
答:4.48L气体中NO为0.1mol,NO2的物质的量为0.1mol.
点评 本题考查氧化还原反应的计算,为高频考点,把握电子、原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 减少有毒物 | B. | 治理污染点 | C. | 处理废弃物 | D. | 杜绝污染源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ MnO4- NO3-Na+ | B. | Na+NH4+Ba2+K+ | ||
| C. | Na+SO32-SO42-K+ | D. | K+Ca2+NO3-K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
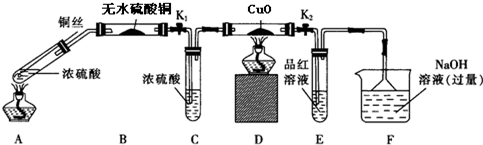
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+ Na+ Cl- SO42- | B. | K+ Na+ Cl- CO32- | ||
| C. | K+ NH4+ SO32- NO3- | D. | K+ CO32- MnO4- AlO2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com