
【题目】常温下,浓度均为0.1 mol/L体积均为V0的HA、HB溶液分别加水稀释至体积为 V的溶液。稀释过程中,pH与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
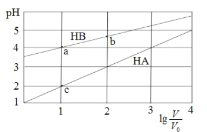
A.pH 随 ![]() 的变化始终满足直线关系
的变化始终满足直线关系
B.溶液中水的电离程度:a > b > c
C.该温度下,Ka(HB)≈ 10-6
D.分别向稀释前的HA、HB溶液中滴加 NaOH 溶液至 pH = 7 时,c(A-)= c(B-)
【答案】C
【解析】
从图中可以看出,0.1mol/LHA的pH=1,HA为强酸;0.1mol/LHA的pH在3~4之间,HB为弱酸。
A.起初pH 随 ![]() 的变化满足直线关系,当pH接近7时出现拐点,且直线与横轴基本平行,A不正确;
的变化满足直线关系,当pH接近7时出现拐点,且直线与横轴基本平行,A不正确;
B.溶液的酸性越强,对水电离的抑制作用越大,水的电离程度越小,由图中可以看出,溶液中c(H+):c >a > b,所以水的电离程度:b >a> c,B不正确;
C.在a点,c(H+)=c(B-)≈10-4mol/L,c(HB)=0.01mol/L,该温度下,Ka(HB)=![]() ≈ 10-6,C正确;
≈ 10-6,C正确;
D.分别向稀释前的HA、HB溶液中滴加 NaOH 溶液至 pH = 7 时,HB中加入NaOH的体积小,所以c(A-)>c(B-),D不正确;
故选C。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g) ![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③2CO(g) ![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:____
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
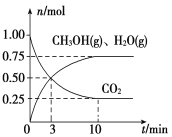
①从反应开始到平衡,氢气的平均反应速率v(H2)=________。
②下列措施一定不能使CO2的平衡转化率增大的是________。
A 在原容器中再充入1 mol CO2
B 在原容器中再充入1 mol H2
C 在原容器中充入1 mol氦气
D 使用更有效的催化剂
E 缩小容器的容积
F 将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:

①上述反应的正反应方向是________反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=_____(填表达式,不必代数计算);如果提高p(H2O)/p(CO),则Kp_______(填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、p(H2O)/p(CO)=3~5,采用此条件的原因可能是_______
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述错误的是________。

A.该装置能量转化形式仅存在将太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+===CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X、Y、M(已知M为乙酸)的转化关系为:淀粉→X→Y![]() 乙酸乙酯,下列说法错误的是
乙酸乙酯,下列说法错误的是
A.X可用新制的氢氧化铜悬浊液检验
B.实验室由Y和M制取乙酸乙酯时可用饱和NaOH溶液来提纯
C.由Y生成乙酸乙酯的反应属于取代反应
D.可用碘水检验淀粉是否水解完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在一定条件下,容积恒定的反应室中充入amolCO与2amolH2,在催化剂作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),下列措施一定使
CH3OH(g),下列措施一定使![]() 增大的是( )
增大的是( )
A.升高温度B.充入Ar(g)使体系的总压增大
C.恒温恒容再充入H2D.恒温恒容再充入amolCO和2amolH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为_______,Co的第四电离能比 Fe 的第四电离能要小得多,原因是__________________________。
(2)Co2+ 、Co3+都能与 CN一形成配位数为6的配离子。CN一中碳原子的杂化方式为____________;HCN分子中含有![]() 键的数目为__________________。
键的数目为__________________。
(3)用KCN处理含Co2+的盐溶液 ,有红色的Co(CN)2 析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6] 4- ,该配离子是一种相当强的还原剂,在加热时能与水反应生成[Co(CN )6]3-,写出该反应的离子方程式:_______________。
(4)金属钴的堆积方式为六方最密堆积,其配位数是 _____。有学者从钴晶体中取出非常规的“六棱柱”晶胞,结构如图所示,该晶胞中原子个数为_____,该晶胞的边长为a nm,高为c nm,该晶体的密度为___gcm-3(NA表示阿伏加德罗常数的值,列出代数式)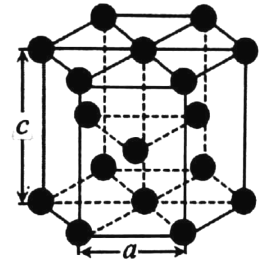
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是()
A.水电离的c(H+)=1×10-13mol/L 的溶液中:K+、Na+、![]() 、
、![]()
B.1.0mol/L的CH3COOH溶液:K+、Fe3+、![]() 、Cl-
、Cl-
C.在c(OH-):c(H+)=1×1012的溶液: ![]() 、Ca2+、Cl-、K+
、Ca2+、Cl-、K+
D.滴入酚酞试剂不变色的溶液:Na+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K1,K2,K3之间的关系为K3=______________。
(2)T℃时,2NO(g)+Cl2(g) ![]() 2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正= k cn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=____________;k=____________(注明单位)。
(3)在2L的恒容密闭容器中充入4mol NO(g)和2mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图A
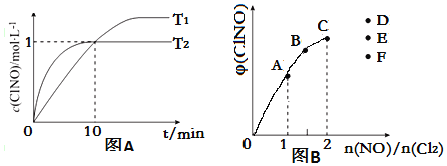
①温度为T1时,能作为该反应达到平衡的标志的有__________;
a 容器体积保持不变
b 容器压强保持不变
c 平衡常数K保持不变
d 气体颜色保持不变
e v(ClNO)= v(NO)
f NO与ClNO的物质的量比值保持不变
②反应开始到10min时Cl2的平均反应速率v(Cl2)=____________;
③温度为T2时,10min已经达到平衡,该反应的平衡常数K
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随n(NO)/n(Cl2)的变化图象如图B,则A、B、C三状态中,NO的转化率最小的是__________点,当n(NO)/n(Cl2)=2.8时,达到平衡状态ClNO的体积分数φ可能是D、E、F三点中的__________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Ⅰ(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基.
Ⅰ可以用E 和H在一定条件下合成:
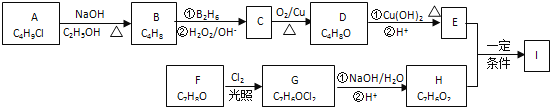
已知:①A的核磁共振氢谱表明其只有一种化学环境的氢;
②RCH=CH2![]() RCH2CH2OH
RCH2CH2OH
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基
(1)A的化学名称为_____________;
(2)D的结构简式为_____________;
(3)I的结构简式为_____________;
(4)写出下列反应的类型:A→B:____________;C→D:____________;
(5)F生成G的化学方程式为:______________;
(6)I的同系物J比I相对分子质量小14,J能同时满足如下条件:①苯环上只有两个取代基,②能发生银镜反应,③能和饱和NaHCO3溶液反应放出CO2;符合上述条件的同分异构体共有__________种(不考虑立体异构).若J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖在不同条件下可以转化成不同物质。
已知:RCOOH+CH2=CH2+![]() O2
O2![]() RCOOCH=CH2+H2O
RCOOCH=CH2+H2O
请回答下列问题:
(1)葡萄糖在酒化酶的催化作用下生成有机物A,A、B、C、D、E间的转化关系如图所示。
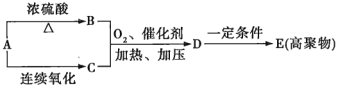
①B是石油化工中最重要的基础原料,写出A→B的化学方程式:_____________;
②D的结构简式为_____________。
(2)葡萄糖在一定条件下可以被氧化为X和Y(Y和A的相对分子质量相同,X的相对分子质量介于A、B之间)。X可催化氧化成Y,也可以与H2反应生成Z。X和Y的结构中有一种相同的官能团是__________,检验此官能团需要使用的试剂是___________。
(3)F是人体肌肉细胞中的葡萄糖在缺氧条件下进行无氧呼吸的产物。F、G、H间的转化关系如图所示:F ![]() G
G ![]() H
H
H与(1)中的D互为同分异构体。
①G还可以发生的反应有______(填序号);
a.加成反应 b.水解反应 c.氧化反应 d.消去反应 e.还原反应
②本题涉及的所有有机物中,与F不论以何种质量比混合(总质量一定),完全燃烧生成CO2和H2O的物质的量不变的有__________________(填结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com