
���� A��B��C��D��E��FΪǰ������Ԫ�أ���ԭ��������������A�ĵ��ӷֲ���������ͬ���ܼ��ϣ���ÿ���ܼ�����ͬ�ĵ���������A��CԪ�أ�
C���������������ڲ��������������ΪOԪ�أ�Bԭ����������A��С��C����B��NԪ�أ�
D��C���γ��������ӻ���������������Ӹ����Ⱦ�Ϊ1��2����D��NaԪ�أ�
E3+��3d������������EΪFeԪ�أ�F��ʹ������Ľ���Ԫ�أ�ΪCuԪ�أ�
��1��E��26��Ԫ��FeԪ�أ���ԭ�Ӻ�����26�����ӣ����ݹ���ԭ����дEԪ�ػ�̬ԭ�ӵĵ����Ų�ʽ��
��2��A��B��C�ֱ���C��N��OԪ�أ�ͬһ����Ԫ�أ��縺������ԭ���������������Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ�
��3������þ��һ������������A��C�γɵĻ�����CO2��Ӧ����MgO��C��
��4��C2O42-Ϊ��������ӣ���������ӱ����Ը��������Һ�����������������̼��Mn2+��
��5����F2+����Һ����μ��백ˮ�����г������ɣ�������ܽ⣬ͭ�����Ⱥ�һˮ�ϰ���Ӧ����������ͭ����������ˮ����ʱ��������ͭ��һˮ�ϰ���Ӧ����ͭ��������ӣ�
��� �⣺A��B��C��D��E��FΪǰ������Ԫ�أ���ԭ��������������A�ĵ��ӷֲ���������ͬ���ܼ��ϣ���ÿ���ܼ�����ͬ�ĵ���������A��CԪ�أ�
C���������������ڲ��������������ΪOԪ�أ�Bԭ����������A��С��C����B��NԪ�أ�
D��C���γ��������ӻ���������������Ӹ����Ⱦ�Ϊ1��2����D��NaԪ�أ�
E3+��3d������������EΪFeԪ�أ�F��ʹ������Ľ���Ԫ�أ�ΪCuԪ�أ�
��1��E��26��Ԫ��FeԪ�أ���ԭ�Ӻ�����26�����ӣ����ݹ���ԭ����дFeԪ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d64s2��
�ʴ�Ϊ��1s22s22p63s23p63d64s2��
��2��A��B��C�ֱ���C��N��OԪ�أ�ͬһ����Ԫ�أ��縺������ԭ���������������Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ���縺��ΪO��N��C����һ�����ܴ�С˳����N��O��C��
�ʴ�Ϊ��O��N��C��N��O��C��
��3������þ��һ������������A��C�γɵĻ�����CO2��Ӧ����MgO��C����Ӧ����ʽΪ2Mg+CO2$\frac{\underline{\;\;��\;\;}}{\;}$2MgO+C��
�ʴ�Ϊ��2Mg+CO2$\frac{\underline{\;\;��\;\;}}{\;}$2MgO+C��
��4��C2O42-Ϊ��������ӣ���������ӱ����Ը��������Һ�����������������̼��Mn2+�����ӷ���ʽΪ2MnO4-+5C2O42-+16H+=2Mn2++10CO2+8H2O��
�ʴ�Ϊ��2MnO4-+5C2O42-+16H+=2Mn2++10CO2+8H2O��
��5����F2+����Һ����μ��백ˮ�����г������ɣ�������ܽ⣬ͭ�����Ⱥ�һˮ�ϰ���Ӧ����������ͭ����������ˮ����ʱ��������ͭ��һˮ�ϰ���Ӧ����ͭ��������ӣ����ӷ���ʽΪCu2++2NH3•H2O=Cu��OH��2��+2NH4+��Cu��OH��2+4NH3=[Cu��NH3��4]2++2OH-��
�ʴ�Ϊ��Cu2++2NH3•H2O=Cu��OH��2��+2NH4+��Cu��OH��2+4NH3=[Cu��NH3��4]2++2OH-��
���� ���⿼��λ�ýṹ�������ϵ��Ӧ�ã�Ϊ��Ƶ���㣬�漰���ӷ���ʽ����д��������ԭ��Ӧ��Ԫ�������ɡ�ԭ�Ӻ�������Ų���֪ʶ�㣬��ȷ����ԭ�������ʽṹ�����������ǽⱾ��ؼ����ѵ��ǣ�5�������ӷ���ʽ����д��ע���һ�����ܹ����еķ���������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��һ���¶��£���1mol X�����1mol Y�������2L�ܱ������У��������·�Ӧ��X��g��+Y��g��?aZ��g��+W��s����H��0��t1ʱ�̴ﵽƽ�⣮��t2��t3ʱ�̷ֱ�ı䷴Ӧ��һ���������������������Z��Ũ����ʱ��ı仯����ͼ��ʾ������˵����ȷ���ǣ�������
��һ���¶��£���1mol X�����1mol Y�������2L�ܱ������У��������·�Ӧ��X��g��+Y��g��?aZ��g��+W��s����H��0��t1ʱ�̴ﵽƽ�⣮��t2��t3ʱ�̷ֱ�ı䷴Ӧ��һ���������������������Z��Ũ����ʱ��ı仯����ͼ��ʾ������˵����ȷ���ǣ�������| A�� | �÷�Ӧ��0��t1ʱ��ε�����Ϊ���ͣ�W��=0.25/t1 mol•L-1•min-1 | |
| B�� | ��Ӧ����ʽ�е�a�����ܵ���1 | |
| C�� | t2ʱ�̸ı��������ͨ����������Z | |
| D�� | t3ʱ�̸ı����������ȥ��������W |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
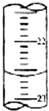 ij�о���ѧϰС����PH=1������ζ�25.00mLδ֪���ʵ���Ũ�ȵ�NaOH��Һ���Ӷ������NaOH��Һ��PHֵ��ѡ�÷�̪��Ϊָʾ����
ij�о���ѧϰС����PH=1������ζ�25.00mLδ֪���ʵ���Ũ�ȵ�NaOH��Һ���Ӷ������NaOH��Һ��PHֵ��ѡ�÷�̪��Ϊָʾ����| �ζ����� | ����Һ�����mL�� | �����������mL�� | |
| �ζ�ǰ������mL�� | �ζ��������mL�� | ||
| ��һ�� | 25.00 | 0.50 | 20.40 |
| �ڶ��� | 25.00 | 4.00 | 24.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ȼ�� | B�� | ���ȼ� | C�� | ���� | D�� | ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3CH2CH2Br | B�� | ��CH3��3CCH2Br | C�� | 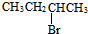 | D�� | 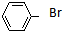 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2 LŨ��Ϊ0.5 mol/L ������Һ�к���NA�������� | |
| B�� | 1molFeCl3���ˮ��Ӧ����NA��Fe��OH��3���� | |
| C�� | ��14g CO�к��е�ԭ����ΪNA | |
| D�� | ��H2O2+Cl2�T2HCl+O2��Ӧ�У�ÿ����32 g������ת�Ƶ�����4 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Һ��SO42-�ķ����ǣ��ȼ���BaCl2��Һ���ټ����� | |
| B�� | ����ˮ���ᴿ������ķ����ǣ�����CCl4��ȡ����Һ�������� | |
| C�� | ������Һ��ͨ���������岻������ѧ��Ӧ | |
| D�� | ��ȥCO2������HCl�ķ����ǣ����������ͨ��ʢ�б���NaHSO3��Һ��ϴ��ƿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
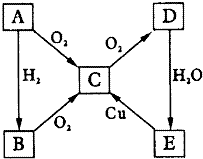 ��ͼ��ʾת����ϵ��AΪ���ʣ��Զ�������������ƶϣ����ش��������⣺
��ͼ��ʾת����ϵ��AΪ���ʣ��Զ�������������ƶϣ����ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com