
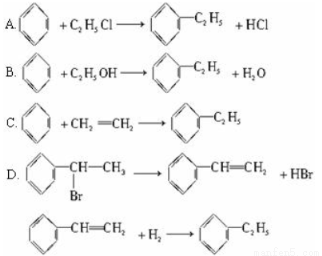
理想的“原子经济”是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是(反应均在一定条件下进行)
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源:2015-2016学年江苏省扬州市高二选修下学期期末调研化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24 L CCl4中含有共价键的数目为0.4 NA
B.常温下,9.2 g NO2和N2O4的混合气体中含有氮原子的数目为0.2 NA
C.电解精炼铜时,若阳极质量减少64g,则阴极得到电子的数目为2 NA
D.0.1mol苯乙烯中含有碳碳双键的数目为0.4 NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性.下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. 若W与Y的原子序数相差5,则二者形成化合物的化学式可能为Y2W3
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. W与X形成的化合物只含离子键
【答案】A
【解析】试题分析:W、X、Y、Z为短周期元素,W、Z同主族,W的气态氢化物的稳定性比Z的气态氢化物的稳定性强,故W、Z为非金属,原子序数Z>W,W处于第二周期,Z处于第三周期,X、Y、Z同周期,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,则原子序数Y>X,且二者处于第三周期,X、Y、Z的原子序数Z>Y>X。A.W、Z同主族,原子序数Z>W,X、Y、Z同周期,X、Y、Z的原子序数Z>Y>X,所以原子半径X>Y>Z>W,正确;B.若W为N元素,Y为Mg元素,二者的原子序数相差5,二者形成化合物的化学式可能为Mg3N2,为Y3W2,错误;C.W的气态氢化物为氨气、水、氟化氢时,分子间存在氢键,沸点高于同族其它氢化物的沸点,W为C、Z为Si时,W氢化物沸点较低,错误;D.若W与X形成的化合物为过氧化钠,既含离子键又含共价键,错误。
考点:考查元素周期表、元素周期律的应用的知识。
【题型】选择题
【适用】一般
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
气相直接水合法制乙醇的方程式为:C2H4 (g)+H2O(g)=C2H5OH(g),其中乙烯的平衡转化率与温度、压强的关系如图[起始n(H2O)︰n(C2H4)=1︰1]。
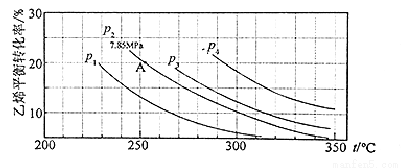
计算乙烯水合制乙醇反应在图中A点的平衡常数KP为(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
A.0.068 MPa-1 B.0.082 C.0.072 MPa-1 D.0.082 MPa-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.研究物质在水溶液中的反应,溶液是环境,盛溶液的烧杯和溶液之外的空气等便是体系
B.能源的开发和利用可以用来衡量一个国家或地区的经济发展和科学技术水平
C.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
D.在稀溶液中,H+(aq) +OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol KOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:实验题
I、已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:

(1)该图中有两处未画出,它们分别是______、______。
(2)做一次完整的中和热测定实验,温度计需使用______次。
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g•℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 13 | 19.8 | △H1 |
HCl+NH3•H2O | 13 | 19.3 | △H2 |
①比较△H1和△H2的相对大小:△H1 △H2(填“>”“<”或“=”)。
②两组实验结果差异的原因是 。
③写出HCl和NH3•H2O反应的热化学方程式: 。
II、如下图所示:用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
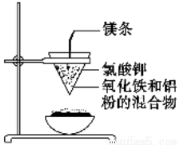
(1)写出该反应的化学方程式:__________,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧 ②放出大量的热,并发出耀眼的光芒,火星四射
③纸漏斗的下部被烧穿 ④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体
(3)写出各物质的作用:蒸发皿盛沙:________;镁条:________;氯酸钾:________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价见下表:
元素代号 | K | L | M | Q | R | T | N |
原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
下列叙述正确的是
A.K、L、M三元素的金属性逐渐增强
B.在RCl2分子中,各原子均满足8电子的稳定结构
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
下列化工生产原理错误的是
①可以用电解熔融的氯化钠的方法来制取金属钠;
②可以用钠加入氯化镁饱和溶液中制取镁;
③用电解法冶炼铝时,原料是氯化铝;
④炼铁时高炉中所发生的反应都是放热的,故无需加热
A.②③ B.①③ C.①②③ D.②③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南师大附中高一实验班下期末理综化学卷(解析版) 题型:选择题
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中.正确的是( )
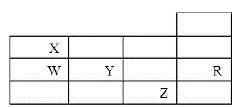
A. 常压下五种元素的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物沸点比X的氢化物的沸点高
D. Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:选择题
丙烯酸(CH2 = CH—COOH)的性质可能有
① 加成反应 ② 水解反应 ③ 酯化反应 ④ 中和反应 ⑤ 氧化反应 ⑥加聚反应
A.只有①③ B.只有①③④ C.只有①③④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com