
����Ŀ����ҵȼ��ú��ʯ�͵Ȼ�ʯȼ���ͷų�������������(NOx)��CO2��CO��SO2�����壬������Ⱦ�������Է���������������̼����������ʵ����ɫ�������������á�
����������֪��H2��ȼ����Ϊ285.8 kJ/mol
N2(g) + 2O2(g)= 2NO2(g) ��H= +133 kJ/mol
H2O(g) =H2O(l) ������ ��H=- 44 kJ/mol
���������£�H2��ԭNO2����ˮ���������������ʵ��Ȼ�ѧ����ʽΪ_____________��
����̼��
��1����2L�����ܱ������м���2 mol CO2��6 mol H2�����ʵ��Ĵ��������£�������Ӧ CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l)������������˵���˷�Ӧ�ﵽƽ��״̬����__________________��
CH3OH(l) + H2O(l)������������˵���˷�Ӧ�ﵽƽ��״̬����__________________��
A����������ƽ��ʽ�����ֲ��� B��CO2��H2������������ֲ���
C��CO2��H2��ת������� D�����������ܶȱ��ֲ���
E��1 mol CO2���ɵ�ͬʱ��3 mol H��H������
��2����T1��ʱ�����Ϊ2L�ĺ��������г������ʵ���֮��Ϊ3mol��H2��CO��������ӦCO(g) + 2H2(g) ![]() CH3OH(g)��Ӧ�ﵽƽ��ʱCH3OH�����������V%����
CH3OH(g)��Ӧ�ﵽƽ��ʱCH3OH�����������V%����![]() �Ĺ�ϵ��ͼ��ʾ��
�Ĺ�ϵ��ͼ��ʾ��
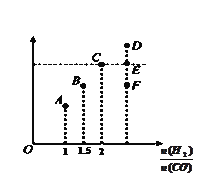
�ٵ���ʼ![]() =2������5min�ﵽƽ�⣬CO��ת����Ϊ0.4����0��5min��ƽ����Ӧ����V(H2)=___________������ʱ���������м���CO��g����CH3OH��g����0.4mol������ƽ��ʱH2��ת���ʽ�__________��ѡ���������С�����䡱����
=2������5min�ﵽƽ�⣬CO��ת����Ϊ0.4����0��5min��ƽ����Ӧ����V(H2)=___________������ʱ���������м���CO��g����CH3OH��g����0.4mol������ƽ��ʱH2��ת���ʽ�__________��ѡ���������С�����䡱����
�ڵ���ʼ![]() =3��5ʱ���ﵽƽ��״̬��CH3OH���������������ͼ���е�___________�㣨ѡ�D������E����F����
=3��5ʱ���ﵽƽ��״̬��CH3OH���������������ͼ���е�___________�㣨ѡ�D������E����F����
������
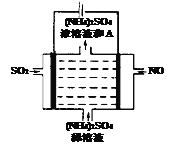
��ͼ���װ�ÿɽ������е�NO��SO2�ֱ�ת��ΪNH4+��SO42��������A�Ļ�ѧʽΪ_____________�������ĵ缫��Ӧʽ��________________________��
���𰸡� 4H2(g)+2NO2(g)��N2(g)+4H2O(g)��H= -1100.2kJ/mol DE 0.08mol/��L��min�� ��С F H2SO4 NO+6H++5e��=NH4++H2O
����������.��֪:������ȼ����Ϊ![]() ,��
,��![]() ����
����![]()
![]() ��
��![]()
![]() ��������
��������![]() ��-��
��-��![]() �õ�������������
�õ�������������![]() ��ԭ
��ԭ![]() ����ˮ�����͵������Ȼ�ѧ����ʽΪ4H2(g)+2NO2(g)��N2(g)+4H2O(g)��H= -1100.2kJ/mol ����ȷ��: 4H2(g)+2NO2(g)��N2(g)+4H2O(g)��H=-1100.2kJ/mol��
����ˮ�����͵������Ȼ�ѧ����ʽΪ4H2(g)+2NO2(g)��N2(g)+4H2O(g)��H= -1100.2kJ/mol ����ȷ��: 4H2(g)+2NO2(g)��N2(g)+4H2O(g)��H=-1100.2kJ/mol��
��1���÷�Ӧֻ�з�Ӧ��Ϊ���壬������ȫ��ΪҺ�壬�����������������������������ȱ仯����������ƽ��ʽ�����ֲ���ʱ�������жϴ˷�Ӧ�ﵽƽ��״̬��A������2L�ܱ������м���2 mol CO2��6 mol H2������![]() ��Ӧ�����Թ�����
��Ӧ�����Թ�����![]() ��
��![]() ���������ʼ�ձ��ֲ����������жϴ˷�Ӧ�ﵽƽ��״̬��B������2L�ܱ������м���2 mol CO2��6 mol H2������
���������ʼ�ձ��ֲ����������жϴ˷�Ӧ�ﵽƽ��״̬��B������2L�ܱ������м���2 mol CO2��6 mol H2������![]() ��Ӧ��
��Ӧ��![]() ��
��![]() ��ת����ʼ�����������ȷ����Ӧ�Ƿ�ﵽƽ��״̬��C��������Ӧ������������������Һ������Ӧ���ҽ��У�������������С������������䣬�����������ܶȱ��ֲ�����˵����Ӧ�ﵽƽ��״̬��D��ȷ��
��ת����ʼ�����������ȷ����Ӧ�Ƿ�ﵽƽ��״̬��C��������Ӧ������������������Һ������Ӧ���ҽ��У�������������С������������䣬�����������ܶȱ��ֲ�����˵����Ӧ�ﵽƽ��״̬��D��ȷ��![]()
![]() ���ɵ�ͬʱ��
���ɵ�ͬʱ��![]()
![]() ��������˵�����淴Ӧ������ͬ����Ӧ�ﵽƽ��״̬��E��ȷ����ȷѡ�DE��
��������˵�����淴Ӧ������ͬ����Ӧ�ﵽƽ��״̬��E��ȷ����ȷѡ�DE��
��2�������������֪��,��T1��ʱ�����Ϊ2L�ĺ��������г����H2��CO�����ʵ����ֱ���2 mol ��1 mol ,��H2��CO�ij�ʼŨ�ȷֱ�Ϊ1mol/L��0.5mol/L,����![]() �ﵽƽ��,CO��ת����Ϊ0.4,����һ����̼�仯Ũ��Ϊ0.2 mol/L ,��ΪŨ�ȵĸñ���֮�ȵ��ڼ�����֮�����ɼ��������Ũ�ȵı仯��0.4mol/L���״�Ũ�ȵı仯��Ϊ0.2mol/L����������ʽ����:
�ﵽƽ��,CO��ת����Ϊ0.4,����һ����̼�仯Ũ��Ϊ0.2 mol/L ,��ΪŨ�ȵĸñ���֮�ȵ��ڼ�����֮�����ɼ��������Ũ�ȵı仯��0.4mol/L���״�Ũ�ȵı仯��Ϊ0.2mol/L����������ʽ����:
CO(g)+ 2H2(g) ![]() CH3OH(g)
CH3OH(g)
��ʼŨ�� 0.5 1 0
�仯Ũ�� 0.2 0.4 0.2
ƽ��Ũ�� 0.3 0.6 0.2
��0��5min��ƽ����Ӧ����V(H2)=0.4/5=0.08mol/��L��min���� ���¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ��0.2/0.3��(0.6)2=50/27������ʱ���������м���CO��g����CH3OH��g����0.4mol��������Ũ��Ϊ��c(CO)=0.3+0.4/2=0.5 mol/L, c(H2)= 0.6 mol/L, c(CH3OH)= 0.2+0.4/2=0.4 mol/L,��Ũ����QC=0.4/0.5��(0.6)2>50/27��ƽ�����ƣ�H2��ת���ʽ���С����ȷ����0.08mol/��L��min������С��
����ϱ������ڻ�ѧ������֮��ʱ,ƽ��ʱ������ĺ���������ʵ���ʼ![]() =3��5ʱ��,�ﵽƽ��״̬��, CH3OH���������С��C������ѡF����ȷѡ��F��
=3��5ʱ��,�ﵽƽ��״̬��, CH3OH���������С��C������ѡF����ȷѡ��F��
������NO��SO2�ֱ�ת��ΪNH4+��SO42����֪��NO����ԭ��SO2�����������ص�����������ԭ��Ӧ��NO�õ��ӱ�ΪNH4+������ӦΪ��NO+6H++5e��=NH4++H2O����������ӦΪ��SO2-2 e��+2H2O= SO42��+4H+,����������Ӧ��֪���÷�Ӧ���ղ������ᣬ����A�Ļ�ѧʽΪH2SO4����ȷ�𰸣�H2SO4��NO+6H++5e��=NH4++H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��ӦA2��g��+B2��g��=2AB��s���������仯��ͼ��ʾ������������ȷ���ǣ������� 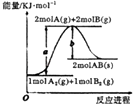
A.�÷�ӦΪ���ȷ�Ӧ
B.�Ӵ����ܽ��÷�Ӧ�ʱ�
C.A��B�ļ���ΪbkJmol��1
D.�÷�Ӧ�ķ�Ӧ��Ϊ��H=��a��b��kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У������ȷ�Ӧ���ǣ� ��
A.��Ƭ��ϡ���ᷴӦB.�Ҵ��ڿ�����ȼ��
C.����������������Һ��ӦD.Ba(OH)28H2O�������Ȼ�茶��巴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У���һ����̼��ˮ����������������ȣ��ڴ��������·�����Ӧ��CO��g��+H2O��g��H2��g��+CO2��g������500��ʱ��ƽ�ⳣ��K=9������Ӧ��ʼʱ��һ����̼��ˮ������Ũ�ȶ���0.02mol/L�����ڴ�������CO��ת����Ϊ��������
A.25%
B.50%
C.75%
D.80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���»����������ҹ�����������ȼ�ϵ�ؼ����з�ȡ����ͻ�ơ���ѧ�����øü���ʵ����H2S������Դ�������������õ��������ԭ����ͼ��ʾ������˵����ȷ����

A. �缫bΪ��ظ���
B. ��·��ÿ����4mol���ӣ���������44.8LH2S
C. �缫b�ϵĵ缫��ӦΪ��O2+4e-��4H+=2H2O
D. �缫a�ϵĵ缫��ӦΪ��2H2S+2O2--4e-=S2+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ��ѡ��3�����ʽṹ������]ij�������о����ڹ����β��Ϻ���˸����������о���ȡ�����ش�ijɾ͡�
��1��SiO44-�ǹ��ɹ����εĻ����ṹ��Ԫ��ͨ���������������γɹ�����Ⱥ��
�ٻ�̬��ԭ�Ӽ۵����Ų�ͼ��________��
����SiO44-��Ϊ�ȵ��������������______����дһ�֣���
����ͼΪһ�ֹ�����Ⱥ�Ľṹʾ��ͼ�������ӷ���Ϊ______,����Siԭ�ӵ��ӻ���ʽΪ____��
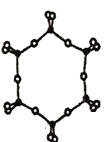
�ܵ縺�ԣ�Si______O���>������=����<��) ��
��2������Ǧ��PWO����һ����˸���壬�����ṹ��ͼ��ʾ��
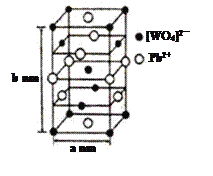
��PWO��������ṹʽʽΪ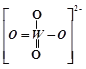 ���������Цļ��ͦм��ĸ�������______��
���������Цļ��ͦм��ĸ�������______��
��PWO�����к��е�������������______�����ţ���
A�����»��� B�����Ӽ�
C�����ۼ� D��������
�ۼ�֪�����Ħ������ΪMg��mol-1����þ�����ܶ�d=_______g��cm-3���������ӵ�������NA��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH3��CH===CH��Cl�����з�Ӧ������ ȡ����Ӧ���� �ӳɷ�Ӧ���� ��ȥ��Ӧ���� ʹ��ˮ��ɫ���� ʹ����KMnO4��Һ��ɫ���� ��AgNO3��Һ���ɰ�ɫ�������� �ۺϷ�Ӧ�����ڸ��л���
A. ���Ϸ�Ӧ���ɷ��� B. ֻ�Т߲��ܷ���
C. ֻ�Т��ܷ��� D. ֻ�Тڲ��ܷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼Ԫ�����������������Ԫ�أ���Ϊ̼Ԫ������������
A. ������������� B. ϸ���к������
C. ������������ D. �����л���Ļ����Ǽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��ZΪ���ֶ���������Ԫ�أ�������Ԫ�����ڱ��е����λ������ͼ��ʾ������Yԭ�ӵ�����������������Ӳ�����2��������˵����ȷ����

A. W���ʱ�X���ʸ�������������
B. W����ۺ������������ȡ����
C. Ԫ��X�����γɵĻ�����ֻ�������Ӽ�
D. �����Ӱ뾶��С��ϵΪ��Y>Z>W>X
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com