
【题目】控制变量法是研究化学变化规律的重要思想方法。请仔细观察下表中50 mL稀盐酸和1 g碳酸钙反应的实验数据:
实验序号 | 碳酸钙状态 |
| 溶液温度/℃ | 碳酸钙消失所需时间/s | |
反应前 | 反应后 | ||||
1 | 粒状 | 0.5 | 20 | 39 | 400 |
2 | 粉末 | 0.5 | 20 | 40 | 60 |
3 | 粒状 | 0.6 | 20 | 41 | 280 |
4 | 粒状 | 0.8 | 20 | 40 | 200 |
5 | 粉末 | 0.8 | 20 | 40 | 30 |
6 | 粒状 | 1.0 | 20 | 40 | 120 |
7 | 粒状 | 1.0 | 30 | 50 | 40 |
8 | 粒状 | 1.2 | 20 | 40 | 90 |
9 | 粒状 | 1.2 | 25 | 45 | 40 |
分析并回答下列问题:
(1)本反应属于 (填“吸热”或“放热”)反应,反应的离子方程式为 。
(2)实验6和7表明, 对反应速率有影响, 反应速率越大,能表明同一规律的实验还有
(填实验序号)。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是 。
(4)本实验中影响反应速率的其他因素还有 ,能表明这一规律的实验序号是1、2与 。
【答案】(1)放热(1分) CaCO3+2H+![]() Ca2++CO2↑+H2O(2分)
Ca2++CO2↑+H2O(2分)
(2)温度(1分) 温度越高(1分) 8和9(1分)
(3)反应物浓度越大,反应速率越大(1分)
(4)接触面积(1分) 4和5(1分)
【解析】(1)反应后溶液的温度升高,可知该反应属于放热反应。
(2)实验7的温度比实验6的高,碳酸钙消失所需的时间短,表明温度越高反应速率越大;能表明同一规律的实验还有8和9。
(3)根据实验1、3、4、6、8中盐酸的浓度不同,且浓度越大碳酸钙消失所需的时间越短,即反应速率越大。
(4)由实验1和2、4和5中只有碳酸钙的状态不同,且粉末状的碳酸钙消失所需的时间短,即固体的表面积越大反应速率越大。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g) △H>0。
2NO(g) △H>0。
己知该反应在2404℃时,平衡常数K = 6.4×10-3。请回答下列问题。
(1)该反应的平衡常数表达式为__________。
(2)该温度下,向2L密闭容器中充入N2和O2各lmol,平衡时,N2的转化率是_____%(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L、3.0×10-3mol/L,此时反应______(填“处于化学平衡状态”、“向正方向进行”或“向逆方向进行”),理由是__________。
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_____。
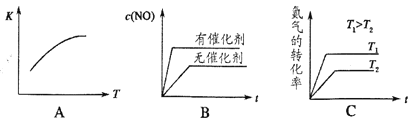
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2, 达到平衡状态后再向其中充入一定量NO, 重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数____(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如下图所示.下列说法正确的是
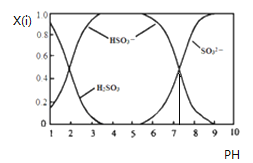
A. pH=8时,溶液中c(HSO3-)>c(SO32-)
B. pH=7时,溶液中c(Na+)=c(HSO3-)+c(SO32-)
C. 为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
D. 由图中数据可估算出c(H+)×c(SO32-)/c(H2SO3)为10-7.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性I﹣>Fe2+>I2,在水溶液中I2可被Cl2氧化为IO3﹣,向含溶质amol的FeI2溶液中通入bmol Cl2,充分反应(不考虑单质与水的反应).
(1)当a=2b时,反应后的粒子浓度之比:c(Fe2+):c(I﹣):c(Cl﹣)=________。
(2)若反应后溶液中I2与IO3﹣的物质的量为1:1,则反应中转移的电子_______mol(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A. 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯
B. 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
C. 乙烯和溴的四氯化碳溶液反应生成1,2﹣二溴乙烷
D. 甲苯与氯气在光照下反应主要生成2,4﹣二氯甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪组离子能在水溶液中大量共存( )
A.K+、NO3-、Al3+、AlO2-B.Na+、SO42-、K+、Cl-
C.SO42-、Ag+、Cl-、K+D.Fe2+、Cl-、H+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为_______________。写出SOCl2吸收水蒸气的化学方程式:_______________________________。
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略):
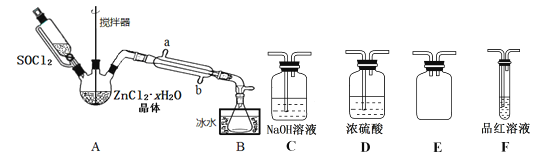
①装置的连接顺序为A→B→____→___→___→____。
②冷凝管的进水口是_______________。(填“a”或“b”)
③实验结束,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤洗涤干燥,称得固体为bg。若b/a=___(保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不行,请解释原因______________________。
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。戊同学设计了如下实验方案判断丁同学的观点:
取少量FeCl3 6H2O于试管中,加入SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应。按照戊同学的思路方法,还可以选择证明__________或______________(填离子符号)是否存在证明该过程是否发生了氧化还原反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com