
| A. | 1molCl2通入足量水中转移电子数为NA | |
| B. | 在0℃、101kPa时,22.4L H2中含有NA个H | |
| C. | 14gN2中含有7NA个电子 | |
| D. | NA个CO分子和0.5molCH4的质量比为7:4 |
分析 A、氯气与水的反应为可逆反应;
B、0℃、101kPa时,气体摩尔体积为22.4L/mol;
C、求出氮气的物质的量,然后根据1mol氮气中含14mol电子来分析;
D、NA个CO分子的物质的量为1mol;
解答 解:A、氯气与水的反应为可逆反应,不能进行彻底,故转移的电子小于NA个,故A错误;
B、0℃、101kPa时,气体摩尔体积为22.4L/mol,故22.4L氢气的物质的量为1mol,则含2mol氢原子就2NA个,故B错误;
C、14g氮气的物质的量为0.5mol,而1mol氮气中含14mol电子,故0.5mol氮气中含7mol电子即7NA个,故C正确;
D、NA个CO分子的物质的量为1mol,质量为28g,而0.5mol甲烷的质量为8g,故质量之比为7:2,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
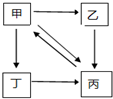 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | Cu | CuCl2 | CuO | Cu(NO3)2 |
| B | Na2CO3 | NaOH | NaHCO3 | CO2 |
| C | Fe | FeCl3 | Fe(OH)3 | Fe2O3 |
| D | Al2O3 | Al(OH)3 | NaAlO2 | AlCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g的NH4+离子中含有的电子数0.1NA | |
| B. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 | |
| C. | 1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移电子均为3NA | |
| D. | 标准状况下,11.2LH2O中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向100mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
向100mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LCCl4含有NA个CCl4分子 | |
| B. | 27g铝被完全氧化成氧化铝,失去2NA个电子 | |
| C. | 在标准状况下,1molNH3和CO混合气体所占的体积约为22.4L | |
| D. | 常温常压下,28g乙烯含有2NA个碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com