
����Ŀ��ˮú����CO ��H2������Ҫȼ�Ϻͻ���ԭ�ϣ�����ˮ����ͨ�����ȵ�̿���Ƶã�C(s) + H2O(g) ![]() CO(g) +H2(g) ��H��+131.3 kJ��mol-1��
CO(g) +H2(g) ��H��+131.3 kJ��mol-1��
��1���÷�Ӧ��ƽ�ⳣ��K���¶ȵ����߶�___________��ѡ����� ��С�����䡱��
��2��������Ӧ�ﵽƽ�����ϵ�е�C(s)�������ߣ�ƽ��____________��ѡ������ơ��������ơ����ƶ�������
��3��������ʵ��˵���÷�Ӧ��һ���������Ѵﵽƽ��״̬����___________������ţ���
A����λ�����ÿ����1 mol CO��ͬʱ����1molH2
B��������������ʵ������ֲ���
C������H2O(g)������������CO���������
D��H2O(g)��CO��H2��Ũ�����
��4��ij�¶��£���4.0 mol H2O(g)��������̿����2 L���ܱ������У��������·�Ӧ��C(s)�� H2O(g) ![]() CO(g)��H2(g)���ﵽƽ��ʱ���K=1������¶���H2O(g)��ת����Ϊ_____��
CO(g)��H2(g)���ﵽƽ��ʱ���K=1������¶���H2O(g)��ת����Ϊ_____��
��5����֪���� C(s)��H2O(l) =CO(g)��H2(g) ��H1
�� 2CO(g)��O2(g)��2CO2 (g) ��H2
�� H2O (l)��H2 (g)��1/2 O2 (g) ��H3
��C(s)��O2 (g)��CO2 (g)�ġ�H��_____________________��
��6���������һ����̼Ϊȼ�ϵļ���ȼ�ϵ�أ�������Ϊͨ��_______���ѧʽ����һ������缫��Ӧʽ�ǣ�__________________________________________________��
���𰸡����� ���ƶ� AB 50% ��H1+��H2/2����H3 O2 O2 + 4e-+ 2H2O=4OH��
��������
��1���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ���
��2������ϵ�е�C��s��ȫ�����ߣ��Է�Ӧ���ʺͻ�ѧƽ�ⶼû��Ӱ�죻
��3�����ݻ�ѧƽ��״̬��������𣬵���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯������ʱҪע�⣬ѡ���жϵ������������ŷ�Ӧ�Ľ��з����仯�������������ɱ仯����ֵʱ��˵�����淴Ӧ����ƽ��״̬��
��4������������ݽ�������ʽ��ͨ��ƽ�ⳣ�����㣻
��5�����ݸ�˹���ɼ��㣻
��6��ͨ�뻹ԭ��һ����̼��һ��Ϊ������ͨ��������һ��Ϊ������
��1���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ�����ѧƽ�ⳣ�����ʴ�Ϊ������
��2��������Ӧ�ﵽƽ�����ϵ�е�C��s��ȫ�����ߣ���Ӱ��ˮ��CO������Ũ�ȱ仯���Է�Ӧ���ʺͻ�ѧƽ�ⶼû��Ӱ�죬ƽ�ⲻ�ƶ����ʴ�Ϊ�����ƶ���
��3��A����λ�����ÿ����1molCO��ͬʱ����1molH2��˵����Ӧ�����淴Ӧ������ȣ�˵���÷�Ӧ��һ���������Ѵﵽƽ��״̬������ȷ��
B����Ӧǰ���������ʵ����仯��������������ʵ������ֲ���˵����Ӧ�ﵽƽ��״̬������ȷ��
C������H2O��g�������ʴ��������ʣ�����CO����������������ʣ����ܱ�����Ӧ�����淴Ӧ������ȣ�����˵����Ӧ�ﵽƽ��״̬���ʴ���
D��H2O��g����CO��H2��Ũ����Ⱥ���ʼ���仯���йأ�������Ϊƽ���־����D����ѡAB���ʴ�Ϊ��AB��
��4����H2O��g����ת����Ϊx�������⽨����������ʽ��
C(s)�� H2O(g) ![]() CO(g)��H2(g)
CO(g)��H2(g)
��mol/L�� 2 0 0
�䣨mol/L�� 2x 2x 2x
ƽ��mol/L�� 2-2x 2x 2x
�ɻ�ѧƽ�ⳣ��K=c(CO)c(H2)/c(H2O)=1,�ɵù�ϵʽ��(2x)2/(2-2x)=1�����ϵʽx=0.5���ʴ�Ϊ��50%��
��5���ɸ�˹���ɷ�Ӧ��+��/2-�ۿɵ�C(s)��O2 (g)��CO2 (g)�����H=��H1+��H2/2����H3,�ʴ�Ϊ����H1+��H2/2����H3��
��6���������һ����̼Ϊȼ�ϵļ���ȼ�ϵ�أ���ͨ�뻹ԭ��һ����̼��һ��Ϊ������ͨ��������һ��Ϊ���������������£������ŵ�ĵ缫��ӦʽΪ���ʴ�Ϊ��O2��O2 + 4e-+ 2H2O=4OH����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��Һ�ڿ����л�������Ϊ
��Һ�ڿ����л�������Ϊ![]() �е�һ�ֻ��֡���֪��
�е�һ�ֻ��֡���֪��![]() ��
��![]() ��һ�־��г�������ζ�����塣����
��һ�־��г�������ζ�����塣����![]() ��Һ���������̽��������˵������ȷ����
��Һ���������̽��������˵������ȷ����
A. ����Ʒ�м�������ϡ���ᣬ������ǣ��ٵμ�![]() ��Һ��������ɫ����������Ʒ��һ������
��Һ��������ɫ����������Ʒ��һ������![]()
B. ����Ʒ�м�������ϡ���ᣬ������������ζ�����壬��Һ����ǣ�����Ʒ�����ٺ���![]() ��
��![]() ���е�һ��
���е�һ��
C. ����Ʒ�м�������ϡ���ᣬ���ȣ�����ʹƷ����Һ��ɫ�����壬��Һ����ǣ�����Ʒ�����ٺ���![]() �е�һ��
�е�һ��
D. ����Ʒ�м�������ϡ���ᣬ���ȣ�����������������ͨ�����Ը��������Һ������ʯ��ˮ��ǰ��δ��ȫ��ɫ�����߱���ǣ�����Ʒ��һ������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£��������һ��������(N2O)�Ͷ�����̼����������Ƚϣ���������ȡ�������̼ԭ�����뵪ԭ������ȡ���������������ȡ�������������ȷ����(����)
A. �٢ڢ� B. �ڢ� C. �٢� D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A. Al������ϡHNO3�У�������˵��Al�����汻HNO3�������γ����ܵ�����Ĥ
B. ��ͼ��ʾ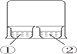 ������ΪAlCl3��Һ������ΪŨ��ˮ�������а�ɫ��������
������ΪAlCl3��Һ������ΪŨ��ˮ�������а�ɫ��������
C. AlCl3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
D. AlCl3��Һ�еμ�NaOH��Һ�����Ĵ�����ʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ�����е����� CaCl2��MgCl2 �� Na2SO4,�������£�
![]()
�����й�˵���У�����ȷ����( )
A. ��ȥ Mg2+����Ҫ��Ӧ�� Mg2++ 2OH-=Mg(OH)2��
B. �Լ���һ������Na2CO3��Һ
C. ���� SO42-�Ƿ������ȡ������Һ����ϡ�����ữ���ټ� BaCl2 ��Һ
D. ��Һ��ϡ����ʱֻ������Ӧ��H+ +OH- =H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� NaOH �� CH3COOH �� NaHCO3 �� HCl��Һ����ѧ��ѧ�г��õ��������ʡ�
��1��pH��ͬ��CH3COOH��HCl��Һ�Ƚϣ����ʵ���Ũ�Ƚϴ����____������ţ���
��2��������������ʵ���Ũ�ȵ�CH3COOH��HCl��Һ��������NaHCO3�����ĩ��Ӧ����ʼ��Ӧ���ʽ�С����_______����ţ���
��3�������£�pH��Ϊ10�� NaOH��NaHCO3 ��Һ����ˮ�������c(OH��)֮��Ϊ_________________��
��4�������£��� 0.10 mol/L NaOH��Һ�ζ� 20.00 mL 0.10 mol/L CH3COOH��Һ��
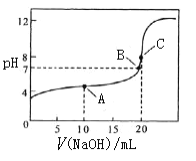
��A������Ϊ____________��д��ѧʽ������ʱc(CH3COO��)_______c(CH3COOH)������ڡ� ����С�ڡ����ڡ���,��Һ��ˮ�ĵ���ƽ��______��������ơ����ٽ�������Ӱ�족��
�ڽ�ϻ�ѧ�������C��pH=8��ԭ��_______________________________________ ��
�����й���B����ж���ȷ����____
a���������������ǡ����ȫ��Ӧ
b�����Һ�е����������
c��c(CH3COO��) �� c(Na��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Զ�ϩ��ȩ����Ϊԭ�Ͼ���DielsAlder��Ӧ�ϳ���ຣ��ϳɹ�ϵ��ͼ��
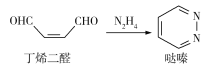
����˵����ȷ����
A. ����������ӳɺ�IJ������ʽΪC4H6N2
B. �۶�ϩ��ȩ����̼̼˫������ʹ��ˮ��ɫ
C. ��ϩ��ȩ��N2H4������һ�������¼ӳɺ�����ȥ���Ƶ����
D. ���ʵ�����ȵĶ�ϩ��ȩ����ືֱ���������ȫ�ӳɣ���������������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ĺ��������������Ϊ��Ǧ���͵Ŀ��������������Է�������������100����C����������Ϊ68.2%����H����������Ϊ13.6%������Ϊ���������ش�
��1���û��������Է���������____________________��
��2��д���û�����ķ���ʽ___________________________��
��3�����û����ﲻ�����Ʒ�Ӧ����������������ͺ˴Ź���������ʾ�÷�������4��������д����ṹ��ʽ��_________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʮ���ƣ�12CaO7Al2O3�������͵ij������Ϻͷ�����ϣ��ð���ʯ����Ҫ��CaCO3��MgCO3���ͷ�AlƬ�Ʊ�����ʮ���ƵĹ������£�
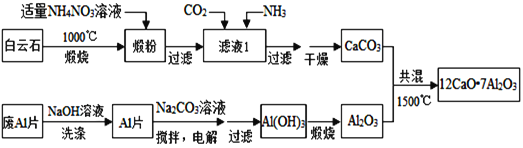
��1���ͷ���Ҫ��______��______��������NH4NO3��Һ��ȡ�ѷۺ�þ�����X�����ܡ��ù����в����ã�NH4��2SO4����NH4NO3��ԭ����_______________________________________________��
��2����Һ������������______���������ʳɷֵ�Ӱ�죩������Һ���н�ͨ��CO2��������______���Ӷ�����CaCO3���ʽ��ͣ�
��3����NaOH��Һ�ɳ�ȥ��AlƬ���������Ĥ����Ӧ�����ӷ���ʽΪ______________________��
��4������Ʊ�Al��OH��3ʱ���缫�ֱ�ΪAlƬ��ʯī������Ƭ�����Դ��____�������ʱ���������ķ�ӦΪ��______��
��5��һ�ֿɳ��������������أ���ŵ�ʱAlCl4����Al2Cl7������������Al�缫���ת�����������Ӳ�����缫��Ӧ���ŵ�ʱ����Al�ĵ缫��ӦʽΪ______________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com