
【题目】在恒容密闭容器中通入物质的量浓度均0.1mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法正确的是( )
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法正确的是( )

A. 上述反应的△H>0 B. 压强P1>P2>P3>P4
C. 1100℃该反应的平衡常数为64 D. 压强为P4时,在Y点:v(正)<v(逆)
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
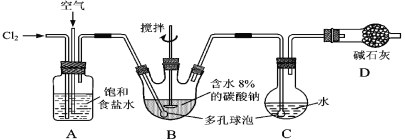
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是____________________________。
②为使反应充分进行,实验中采取的措施有______________________________。
③装置D的作用是______________________________。
(2)①装置B中产生Cl2O的化学方程式为:____________________________________。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是_____________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用______(填“酸”或“碱”)式滴定管取20.00 mL次氯酸溶液,加入足量的______,再加入足量的______,过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。 (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、M的原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2电子层结构与氖相同。
(1)M位于元素周期表中第______周期______族。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_________。
(3)由X、Y、Z三种元素可组成摩尔质量为84g/mol的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_______________。
(4) (XY)2的性质与Cl2相似,(XY)2与NaOH溶液反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C. 已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol,代表任何酸碱反应的中和热都是ΔH=-57.3 kJ/mol
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤粉隔绝空气加强热,除主要得到焦炭外,还能得到下表所列的物质:
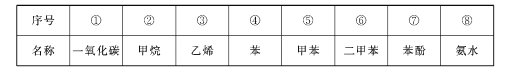
回答下列问题:
(1)天然气的主要成分是____(填序号);
(2)滴加氯化铁溶液能变为紫色的是____(填序号);
(3)可用于生产制尼龙的原料环己烷的是____(填序号);
(4)能发生加聚反应,生成物可用来制造食品包装袋的是____(填序号);
(5)甲苯的一氯取代产物有___种;
(6)二甲苯的三种同分异构体中,沸点最低的是_____(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有某硫酸和硝酸的混合溶液20 mL,其中含硫酸的浓度为2 mol·L-1,含硝酸的浓度为1 mol·L-1,现向其中加入0.96 g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
A. 224 mLB. 168 mL
C. 112 mLD. 89.6 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)11种元素中,化学性质最不活泼的是_________________。非金属性最强的元素的原子结构示意图为__________________。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是________________________。
(3)②③④形成的简单离子半径由大到小的顺序是__________________________。
(4)元素⑦的氢化物分子式为_______________,该氢化物常温下和元素②的单质反应的离子方程式是____________________________________________。
(5)⑨的最高价氧化物对应的水化物化学式为__________________。①和⑨两元素形成化合物的电子式为___________________。
(6)①、⑥和⑦形成的化合物的化学式为__________________。该化合物的化学键类型为___________________________。
(7)⑧⑨三种元素形成的气态氢化物最稳定的是____________,沸点最高的是______________。
(8)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为____________________________。
(9)下列可以判断①和⑤金属性强弱的是____________________________。
a. ①单质的熔点比⑤单质低
b. ①质软,氧化物种类比⑤多
c. ①单质与水反应,⑤单质几乎不与水反应
d. ①最高价氧化物的水化物的碱性比⑤强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中发生如下事故,处理方法正确的是
A.少量浓硫酸溅在皮肤上,立即用NaOH溶液冲洗
B.酒精洒在桌面上引起失火,可用水浇灭
C.轻度烧伤、烫伤可用冰水或者冷水降温止痛
D.误服可溶性钡盐,可及时服用Na2CO3溶液解毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com