
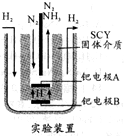
 氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.| 1 |
| 2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol.L-l) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
| 1 |
| 2 |


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向两份蛋白质溶液中分别滴加NaCl溶液和 CuSO4溶液.均有固体析出 | 蛋白质均发生了变性 |
| B | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化, 滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经 变质 |
| C | 将少量某物质的溶液滴加到新制的银氨溶液中, 水浴加热后有银镜生成 | 该物质一定属于醛类 |
| D | 同条件下,分别将0.1mol?L-1的盐酸和醋酸进 行导电性实验,与醋酸串联的灯泡较暗 | 醋酸是弱酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠溶液中滴入盐酸 |
| B、水中加入钠 |
| C、氨水中加入少量NH4Cl 固体 |
| D、醋酸溶液微热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
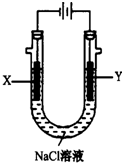 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:
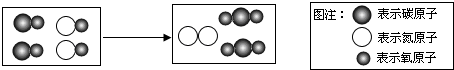
| A、图中单质的化学式为N2 |
| B、该反应使有毒气体转化为无毒气体 |
| C、反应物都属于氧化物 |
| D、反应中原子、分子个数都不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、①③ | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
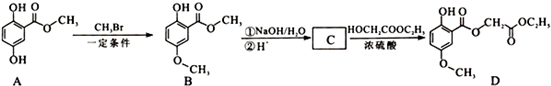
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com