
【题目】通过简单的计算完成下列问题:
(1)已知:常温下HF的Ka=1×10-4,NH3H2O的Kb=1×10-5,则NH4F溶液显_______性,保存此溶液应该放在_______中。
(2)已知:常温下 H2S的Ka1=1×10-7、Ka2=1×10-15,CuS的Ksp=1×10-36,FeS的Ksp=1×10-17,则:
①反应CuS(s)+2HCl(aq)![]() H2S(aq)+CuCl2(aq)的K=__________;反应FeS(s)+2HCl(aq)
H2S(aq)+CuCl2(aq)的K=__________;反应FeS(s)+2HCl(aq)![]() H2S(aq)+FeCl2(aq)的 K=_____;
H2S(aq)+FeCl2(aq)的 K=_____;
由计算结果我们可以知道CuS和FeS中________可溶于盐酸。
②反应 CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的K=_____;除去废水中的 Cu2+使用过量的FeS固体的优点有:a.可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;b. _________________________________。
FeS(s)+Cu2+(aq)的K=_____;除去废水中的 Cu2+使用过量的FeS固体的优点有:a.可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;b. _________________________________。
(3)已知:常温下 Fe(OH)3的 Ksp=1×10-38,则 Fe3+沉淀完全的pH=______;配置FeCl3溶液的方法是______。(以浓度≤10-5mol/L为沉淀完全)
【答案】 酸 塑料瓶 10-14 105 FeS 10-19 进入废水中的Fe2+被空气中 的O2氧化,生成的Fe3+水解产生Fe(OH)3 胶体,吸附杂质使杂质沉降 3 将FeCl3固体溶于较浓的 HCl 中,再加水稀释至所需浓度
【解析】(1)已知:常温下HF的Ka=1×10-4,NH3H2O的Kb=1×10-5,则铵根离子的水解程度大于氟离子的水解,则NH4F溶液显酸性,水解产生氢氟酸,故保存此溶液应该放在塑料瓶中;(2)①反应CuS(s)+2HCl(aq)![]() H2S(aq)+CuCl2(aq)的
H2S(aq)+CuCl2(aq)的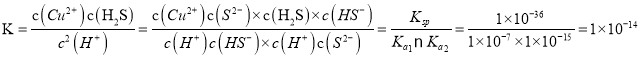 ,反应FeS(s)+2HCl(aq)
,反应FeS(s)+2HCl(aq)![]() H2S(aq)+FeCl2(aq)的
H2S(aq)+FeCl2(aq)的 ![]() ;②反应 CuS(s)+Fe2+(aq)
;②反应 CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的
FeS(s)+Cu2+(aq)的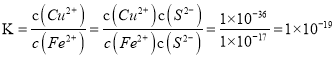 ;除去废水中的 Cu2+使用过量的FeS固体的优点有:a.可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;b. 进入废水中的Fe2+被空气中 的O2氧化,生成的Fe3+水解产生Fe(OH)3 胶体,吸附杂质使杂质沉降;(3)已知:Fe3+沉淀完全的浓度为
;除去废水中的 Cu2+使用过量的FeS固体的优点有:a.可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;b. 进入废水中的Fe2+被空气中 的O2氧化,生成的Fe3+水解产生Fe(OH)3 胶体,吸附杂质使杂质沉降;(3)已知:Fe3+沉淀完全的浓度为![]() ,常温下 Fe(OH)3的 Ksp=c(Fe3+)c3(OH-)=
,常温下 Fe(OH)3的 Ksp=c(Fe3+)c3(OH-)= ![]() ×c3(OH-)=1×10-38,则 c(OH-)=1×10-11,Fe3+沉淀完全的pH=3;为防止FeCl3水解,配置FeCl3溶液的方法是将FeCl3固体溶于较浓的 HCl 中,再加水稀释至所需浓度。
×c3(OH-)=1×10-38,则 c(OH-)=1×10-11,Fe3+沉淀完全的pH=3;为防止FeCl3水解,配置FeCl3溶液的方法是将FeCl3固体溶于较浓的 HCl 中,再加水稀释至所需浓度。


科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:
CH3OH(g)+CO(g) ![]() CH3COOH(g)△H<0。下列说法正确的是
CH3COOH(g)△H<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. 达平衡时,容器I与容器II中的总压强之比为3:4
B. 达平衡时,容器II中![]() 比容器I中的大
比容器I中的大
C. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
D. 达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置可以进行实验并能达到实验目的的是
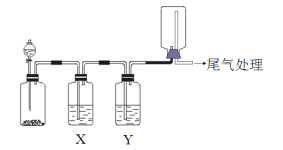
选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 用CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
D | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的含量是衡最大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3k/mol和-297.2kJ/mol,则CH4和SO2反应的热化学方程式为_____________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
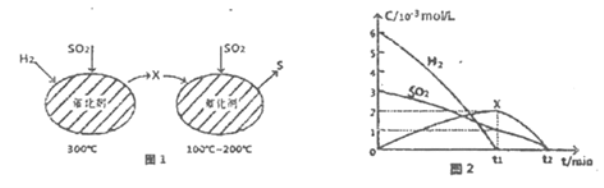
①分析可知X为______(写化学式),0~t1时间段的温度为_____,0~t1时间段用SOz表示的化学反应速率为________。
②总反应的化学方程式为_____________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。

①该反应的△H____0(填“>”或“<”)
②算a点的平衡常数为_________。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1mo/L的Na2SO3溶液吸收SO2。当溶液pH=7时,溶液中各离子浓度的大小关系为________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化合物,物质之间存在如右下图所示的关系。下列说法不正确的是

A. 离子半径大小关系:Y>Z>X>W
B. YX2遇到蓝色石蕊试液先变红后褪色
C. 简单阴离子的还原性:Y>Z
D. Y与Z属于同一周期,与X属于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是


A. Ⅰ图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B. Ⅱ图中:闻Cl2的气味
C. Ⅲ图中:生成棕黄色的烟
D. Ⅳ图中:若气球干瘪,证明Cl2可与NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向40mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如下图所示:
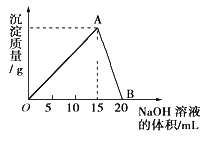
(1)写出AB段发生反应的离子方程式___________。
(2)A点表示的意义是__________。
(3)当所得沉淀量为0.39g时,用去NaOH溶液的体积是_______ mL。
(4)向B点处的溶液中通入少量CO2会有什么现象________写出离子方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com