
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
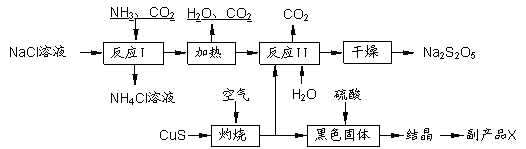 |
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)反应I的化学方程式为: 。
(3)“灼烧”时 发生反应的化学方程式: 。
发生反应的化学方程式: 。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(5)副产品X的化学式是 。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下表标出的是元素周期表的一部分元素,回答下列问题:
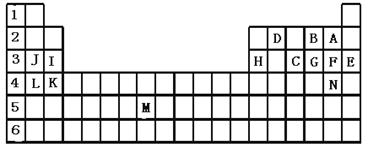 |
(1)表中用字母标出的15种元素中,化学性质最不活泼的是 (用元素符号表示,下同),金属性最强的是 ,非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物的化学式分别为 、 、 ,其中以 最不稳定。
(3)第三周期中原子半径最小的是 (稀有气体元素除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① |
| ||||||||||||||||
|
| ② |
| ③ | ④ | ⑤ | ⑥ |
| ||||||||||
|
| ⑦ |
| ⑧ |
|
|
|
| ||||||||||
|
|
|
|
|
| ⑨ |
|
|
|
| ⑩ |
|
|
|
|
|
|
|
(1)写出上表中元素⑤的轨道表示式_______,元素⑨原子的核外电子排布式__________。
(2)元素第一电离能的大小比较:④_____⑤(填写“>”“=”或“<”,下同);元素电负性的大小比较:④_____⑤(填写“>”“=”或“<”);请写出与元素④的单质互为等电子体的一种微粒的化学式_________。
(3)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是__________。
(4)上述③与④元素组成的(CN)2化合物中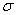 键与
键与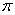 键之比________。
键之比________。
(5)⑦的氧化物是优良的耐高温材料,它的熔点比 CaO高,其原因是_____________。
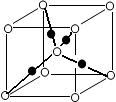
(6)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则该氧化物的化学式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用酸性KMnO4溶液不能达到 预期目的的是
预期目的的是
A.区别苯和甲苯 B.检验硫酸铁溶液中是否有硫酸亚铁
C.检验CH2=CHCHO中含碳碳双键 D.区别SO2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
我国科研人员以蹄叶橐吾为原料先制得化合物Ⅰ,再转化 为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是
为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是
A.化合物Ⅰ能使酸性KMnO4溶液褪色
B. 化合物Ⅰ分子中含有5个手性碳原子
C.化合物Ⅱ一定条件下能发生取代、消去及加成反应
D. 检验化合物Ⅱ是否含化合物Ⅰ可用Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1) Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为________。
 ②BH
②BH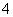 的空间构型是________(用文字描述)。
的空间构型是________(用文字描述)。
(2) 液氨是富氢物质,是氢能的理想载 体,利用N2+3H2
体,利用N2+3H2
 2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。
2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。
A. NH3分子中N原子采用sp3杂化
B. 相同压强时,NH3沸点比PH3高
C.[Cu (NH3)4]2+离子中,N原子是配位原子
D.CN-的电子式为[:C┇┇N:]-
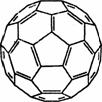 (3) 2008年,Yoon等人发现Ca与C60(分子结构如下图左)生成的Ca32C60能
(3) 2008年,Yoon等人发现Ca与C60(分子结构如下图左)生成的Ca32C60能 大量吸附H2分子。
大量吸附H2分子。

①C60晶体 易溶于苯、CS2,C60是________分子(填“极性”或“非极性”)。
易溶于苯、CS2,C60是________分子(填“极性”或“非极性”)。
②1 mol C60分子中,含有σ键数目为________。
(4) MgH2是金属氢化物储氢材料,其晶胞结构如上图右所示,已知该晶体的密度为a g·cm-3,则晶胞的体积为________cm3[a、NA表示(NA表示阿伏加德罗常数的值)]。
查看答案和解析>>
科目:高中化学 来源: 题型:
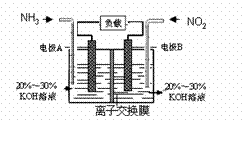
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是( )
A.电流从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
我国科学家最近指出:2050年后全球将出现的四大能源是,①氚和氦-3的核聚变 ②天然气水合物 ③空间太阳能发电 ④氢能。这四大能源未来在提供能量过程中会产生新核素的是( )
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“<”、“>”或“=”);
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol 的A和0.80 mol 的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=________ mol·L-1,C的物质的量为________mol;若反应经一 段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol 氩气,平衡时A的转化率为________;
段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol 氩气,平衡时A的转化率为________;
(3)判断该反应是否达到平衡的依据为________(填正确选项前的字母);
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1 200 ℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com