
下列说法不正确的是
A.金属单质和盐溶液的反应不一定是置换反应
B.质量数相等的不同核素,一定属于不同种元素
C.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则原溶液中一定有SO42-
D.Al2O3既能与强酸反应,又能与强碱反应,Al2O3属于两性氧化物
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是

A.图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线 Ⅱ为盐酸,且b点溶液的导电性比a点强
Ⅱ为盐酸,且b点溶液的导电性比a点强
B.图2中纯水仅升高温度,就可以从a点变到c点
C.图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D.用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:实验题
(14分)过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:

已知:主反应:2Na2CO3 (aq) + 3H2O2 (aq)  2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应:2H2O2 = 2H2O + O2↑
50℃时2Na2CO3·3H2O2 (s) 开始分解

请回答下列问题:
(1)步骤①的关键是控制温度,原因是 ,其措施有_______、_________和_________。
(2)在滤液X中加入适量NaCl固体可析出过碳酸钠,原因是_________________。
(3)步骤③中选用无水乙醇洗涤产品的目的是 。
(4)下列物质中,会引起过碳酸钠失效的有 。
A.NaHCO3 B.MnO2 C.Na2SiO3 D.Na2SO3
(5)过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶解→加入BaCl2溶液→过滤→洗涤→干燥→称量。需要直接测定的物理量有: 样品的质量m1g、沉淀的质量m2g(用字母表示并注明其含义)。产品中过碳酸钠质量分数的表达式为: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省仙桃天门潜江高三上学期期末联考理综化学试卷(解析版) 题型:选择题
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中正确的是
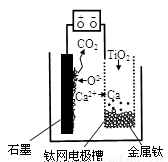
A.将熔融CaF2—CaO换成Ca(NO3)2溶液也可以达到相同目的
B.阳极的电极反应式为:C+2O2--4e-=CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:填空题
(13分)研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。则CO2(g)+3H2(g)=CH3OH(g)+H2O(l) H= kJ·mol-1。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①该反应平衡常数表达式K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的H 0(填“>”或“<”)。若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将 (填“增大”、“减小”或“不变”)。
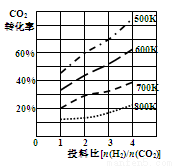
③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是 。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(3)向澄清的石灰水中通入CO2至溶液中的Ca2+刚好完全沉淀时,则溶液中c(CO32-)= 。[已知:Ksp(CaCO3)=2.8×10-9]
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高一上学期期末考试化学试卷(解析版) 题型:填空题
(9分)硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:

(1)要将洗出液中的溶质析出,采用的方法是 (填:“蒸发”、“降温”)结晶;蒸发时用到的硅酸盐仪器有 、 、 。
(2)上流程中加入NaOH溶液,反应的离子方程式为 。
(3)用上述残渣中的氧化铁焊接铁轨,其铝热反应的化学方程式为(并在方程式中用“单线桥”标出电子转移方向和数目) 。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4LSO3含有NA个分子
B.标准状况下,22.4LCO2与CO的混合气体含NA个分子
C.1molNa2O2与足量CO2反应转移的电子数为NA
D.常温下NA个H2分子的质量约为2g,它所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高二上学期期末考试化学试卷(解析版) 题型:简答题
(6分)用简短的文字和方程式解答下列问题:
(1)Na2CO3溶液可做洗涤剂去除油污,而且热的溶液去污效果更好。其原因是 。
(2)实验室有两瓶失去标签且pH=3的溶液,已知它们是稀盐酸和醋酸,请写出区别它们的一种方法: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市五校高二上学期期末联考化学试卷(解析版) 题型:填空题
(12分)现有常温下的0.1 mol·l-1纯碱溶液。
(1)该溶液呈碱性是因为存在水解平衡,相关离子方程式是:________________。为证明存在上述平衡,进行如下实验:在0.1 mol·l-1纯碱溶液中滴加酚酞,溶液显红色,再往溶液中滴加 (填化学式)溶液,红色逐渐退为无色,说明上述观点成立。
(2)同学甲查阅资料得知常温下0.1 mol·L-1Na2CO3中,发生水解的CO32—不超过其总量的10%。请设计实验加以证明(写出实验方案及预期观察到的现象)。
答: 。
(3)同学乙就该溶液中粒子浓度关系写出五个关系式,其中不正确的是 。(双选,填序号)
A.c(Na+)>2c(CO32—)
B.c(CO32—)>c(OH-)>c(HCO3—)>c(H2CO3)
C.c(OH-)=c(H+)+c(HCO3—)+2c(H2CO3)
D.c(CO32—)+c(HCO3—)=0.1 mol·L-1
E.c(H+)+ c(Na+)= c(OH-)+c(HCO3—)+c(CO32—)
(4)室温下,pH均为13的Na2CO3和NaOH溶液中,水电离产生的c(OH—)之比= 。
(5)25℃下,CuSO4溶液中的c(Cu2+)为0.020 mol/l,如果要生成沉淀,应调整溶液的pH大于 。
(25℃下,Cu(OH)2 的 Ksp=2.0×10-20)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com