
��18�֣���ҵ��һ���ں����ܱ������п��Բ������з�Ӧ�ϳɼ״���
CO(g) �� 2H2(g)  CH3OH(g) ��H
CH3OH(g) ��H
��1���жϷ�Ӧ�ﵽƽ��״̬�������� ������ţ���
a�� ����CH3OH������������CO���������
b�� ���������ܶȲ���
c�� �������������ʵ�������
d�� CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
��2��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ1��
�ٸ÷�Ӧ��H___0���������������
��ʵ����������������250�桢1.3��104 kPa���ң�ѡ���ѹǿ��������_______��
��3����ͼ2��ʾ���¶ȷֱ�ΪT1��T2ʱ��ƽ����ϵ��H2�����������ѹǿ�仯���ߣ�A��C����ķ�Ӧ����A____C�����������������������ͬ����A��C����Ļ�ѧƽ�ⳣ��A_____C����״̬B��״̬A���ɲ���______�ķ���������¡����¡�����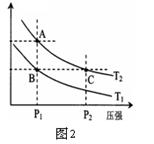
��4��һ�������£�0.5mol�״�������ȫȼ�����ɶ�����̼�����Һ̬ˮ���ų�Q KJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
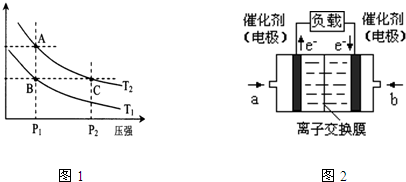
��5��ͼ3�Ǽ״�ȼ�ϵ�أ��������ҺΪKOH��Һ���ṹʾ��ͼ��д�� a���缫�Ϸ����ĵ缫��Ӧʽ ��
��1��c d ��2�֣�
��2���� ����2�֣� �ڡ���1.3��104Kpa�£�COת�����ѽϸߣ�������ѹǿCOת������߲��������ɱ����ӣ��ʵò���ʧ����2�֣�
��3������= �����£���6�֣���2�֣�
��4��2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ��H=" -4Q" kJ/mol��3�֣�
��5��CH3OH-6e-+8OH- = CO32-+6H2O��3�֣�
���������������1��a.����˵����Ӧ���ʣ�����˵��ƽ�⡣b.��������������䣬���ҷ�Ӧǰ�������غ㣬�����ܶ�Ҳ�������ı䡣c.���ڷ�Ӧǰ�����ʵ��������ı䣬�����ٸı�ʱ�ﵽƽ�⡣d.��Ũ�Ȳ��ٸı�ʱ��˵�����淴Ӧ������ȣ��ﵽƽ�⡣
��2�������������¶ȣ�CO��ת���ʼ�С����Ӧ�����ƶ���˵����Ӧ���ȣ���H>0������1.3��104Kpa�£�COת�����ѽϸߣ�������ѹǿCOת������߲��������ɱ����ӡ�
��3���Ӵ�ѹǿ���������������С����Ӧ���ƣ�������A�㷴Ӧ����С��C�㡣��ͬһ�¶��£�ƽ�ⳣ����ȡ���B�䵽A��ֻ���¶ȷ����仯��ѹǿ���䣬����ֻ��Ҫ���¡���4����д��ѧ����ʽ������ʶ��ÿһ�����ʵ�״̬���������ʱ䣬�������ź͵�λ����5���״���������ʧ���ӣ�����̼�����ˮ��
���㣺��ѧ��Ӧƽ��ԭ����ƽ�ⳣ���ıȽϣ��Ȼ�ѧ����ʽ����д��ԭ��صĵ缫��Ӧ��
�����������ۺ��Խ�ǿ�������˺ܶ������֪ʶ�㣬ѧ����Ҫ�������գ��ѶȲ���


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 CH3OH��g����H
CH3OH��g����H| �¶� | 250��C | 300��C | 350��C |
| K | 2.041 | 0.270 | 0.012 |
| V2 |
| a2 |
| V2 |
| a2 |
| ���� | �� | �� | �� | |
| ��Ӧ��Ͷ���� | 1molCO��2moL H2 | 1molCH3OH | 2molCH3OH | |
| ƽ �� ʱ �� �� �� |
CH3OHŨ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | akJ | bkJ | ckJ | |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 | |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| ���� |
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
| ���� | �� | �� | �� | |
| ��Ӧ��Ͷ���� | 1molCO��2molH2 | 1molCH3OH | 2molCH3OH | |
| ƽ��ʱ���� | CH3OH��Ũ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | akJ | bkJ | ckJ | |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 | |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com