
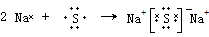 .
.分析 A、B、C、D四种短周期元素,它们的核电荷数依次增大,有一种元素的单质易溶于CS2溶剂中,该单质为S;根据“B、D两元素的质子数之和是A、C两元素的质子数之和的两倍”可知D为S元素、B为O;B、D两元素的质子数之和是A、C两元素的质子数之和的两倍,则A、C质子数之和为:$\frac{8+16}{2}$=12,则A、C同族,则A为H元素、C为Na元素,据此进行解答.
解答 解:A、B、C、D四种短周期元素,它们的核电荷数依次增大,有一种元素的单质易溶于CS2溶剂中,该单质为S;根据“B、D两元素的质子数之和是A、C两元素的质子数之和的两倍”可知D为S元素、B为O;B、D两元素的质子数之和是A、C两元素的质子数之和的两倍,则A、C质子数之和为:$\frac{8+16}{2}$=12,则A、C同族,则A为H元素、C为Na元素,
故答案为:氢;O;
(2)C元素的单质为Na,A2B为H2O,金属Na与水H2O反应生成NaOH和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)C元素跟D元素形成的化合物的化学式为Na2S,硫化钠为离子化合物,离子和原子都满足8电子稳定结构,离子键形成过程为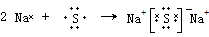
故答案为: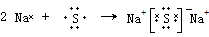
(4)两种均含有这四种元素的化合物为NaHSO3、NaHSO4,二者相互反应的离子方程式为:HSO3-+H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O.
点评 本题考查位置结构与性质关系的应用,题目难度中等,推断各元素为解答关键,侧重考查学生分析推理能力,需要注意熟练掌握原子结构与元素周期表,试题侧重考查学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 1 mol Cu和2mol热的浓硫酸反应可生成NA个SO2分子 | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| D. | 标准状况下,22.4 L N2和H2混合气中含NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 每生成2molAB吸收b kJ热量 | |
| B. | 该反应热△H=(b-a)kJ•mol-1 | |
| C. | 该反应为吸热反应 | |
| D. | 断裂1 mol A-A和1 mol B-B键放出a kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.20 | B. | 0.16 | C. | 0.12 | D. | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打Na2CO3,苛性钠NaOH | B. | 明矾KAl(SO4)2•12H2O,消石灰Ca(OH)2 | ||
| C. | 苏打NaHCO3,石灰石CaCO3 | D. | 纯碱NaOH,食盐NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com