
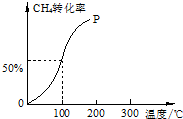
 以CH4和H2O为原料,通过下列反应来制备甲醇.
以CH4和H2O为原料,通过下列反应来制备甲醇.分析 (1)已知I:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.0kJ•mol-1
II:CO(g)+2H2(g)?CH3OH(g)△H=-129.0kJ•mol-1
根据盖斯定律,Ⅰ+Ⅱ可得:CH4(g)+H2O(g)?CH3OH(g)+H2(g);
(2)100℃时达到平衡时,甲烷转化率为50%,结合化学平衡三段式列式计算平衡时各组分的物质的量,
①根据c=$\frac{\frac{△n}{V}}{△t}$计算v(H2);
②计算平衡状态时各物质的浓度,代入平衡常数表达式K=$\frac{c(CO)×{c}^{3}({H}_{3})}{c(C{H}_{4})×c({H}_{2}O)}$;
(3)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(4)其他条件不变,平衡后将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,正、逆反应速率都增大,但正反应速率增大更多,平衡向正反应方向移动,生成物的浓度增大,由于温度不变,则平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,据此分析解答.
解答 解:(1)已知I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ•mol-1
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ•mol-1
根据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g) 则△H=+206.0kJ•mol-1-129.0kJ•mol-1=+77kJ•mol-1,
故答案为:+77;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=$\frac{\frac{1.5mol}{100L}}{5min}$=0.003 mol•L-1•min-1,
故答案为:0.003 mol•L-1•min-1;
②100℃时反应I的平衡浓度为c(CH4)=0.050mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,
平衡常数K=$\frac{c(CO)×{c}^{3}({H}_{3})}{c(C{H}_{4})×c({H}_{2}O)}$=$\frac{0.005×0.01{5}^{3}}{0.005×0.015}$=2.25×10-4,
故答案为:2.25×10-4;
(3)A.有2个H-H键生成的同时有3个C-H键断裂,均表示逆反应速率,反应始终按该比例关系进行,故A错误;
B.可逆反应到达平衡时各组分含量不变,CO百分含量保持不变,说明反应到达平衡,故B正确;
C.随反应进行混合气体物质的量减小,恒温恒容下压强减小,容器中混合气体的压强保持不变,说明反应到达平衡,故C正确;
D.混合气体总质量不变,容器容积不变,容器中混合气体的密度为定值,故D错误,
故选:BC;
(4)A.平衡后将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误;
B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误;
C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确;
D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡$\frac{{c({H_2})}}{{c(C{H_3}OH)}}$减小,故D正确;
E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误,
故答案为:CD.
点评 本题考查化学平衡计算与影响因素、化学平衡状态判断、化学平衡图象、平衡常数与反应速率计算、盖斯定律应用等,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡,题目难度中等.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
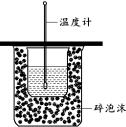 下列实验操作正确的是( )
下列实验操作正确的是( )| A. | 用图装置测定中和热 | |
| B. | 将同浓度的FeCl3溶液和CuSO4溶液分别滴入H2O2中,滴入FeCl3溶液的H2O2更快产生气泡.不能得出结论对H2O2分解的催化效果Fe3+>Cu2+ | |
| C. | 研究H+浓度对该平衡:Cr2O72-+H2?2CrO42-+2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸 | |
| D. | 测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏伽德罗常数NA可近似表示为$\frac{m+n}{22.4}$mol-1 | |
| B. | 标准状况下,32g O3和O2的混合气体中,含有氧原子数一定为2NA | |
| C. | 等体积、等浓度的磷酸溶液和盐酸溶液,其溶液中含有的氢元素质量之比一定为3:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比一定为2:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质能透过滤纸 | |
| B. | 胶体能产生丁达尔现象 | |
| C. | 胶体粒子直径在10-9~10-7 m之间 | |
| D. | 胶体是纯净物,其它分散系是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
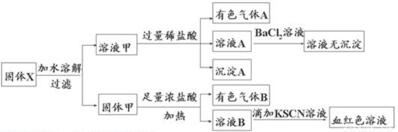
| A. | 溶液甲中一定含有K2SO3、NaNO2 | B. | 无法判断溶液中是否有K2SO3 | ||
| C. | 气体A和气体B-定为混合物 | D. | 原混合物中一定有Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)═c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)═c(Na+)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com