
【题目】在恒温恒容的密闭容器中,发生可逆反应2NO(g)+O2(g)![]() 2NO2(g),不能说明该反应已经达到平衡状态的是
2NO2(g),不能说明该反应已经达到平衡状态的是
A. 正反应生成NO2的速率和逆反应生成NO的速率相等
B. 反应容器中压强不随时间的延长而变化
C. 混合气体颜色深浅保持不变
D. 混合气体的密度不随时间延长而变化
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】图1表示甲,乙两种无机盐离子处于不同浓度时与作物产量的关系;图2表示不同浓度钙对某植物花粉萌发和花粉管生长的影响。下列描述正确的是

A.同种作物对甲、乙两种离子的需求量相同
B.从生产实际考虑,c、d浓度相比,要想提高产量,d浓度为最佳
C.适宜浓度的钙有利于花粉管的生长
D.在一定范围内,钙的浓度对花粉萌发率有影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取并收集氯气的装置如图所示,请回答下列问题
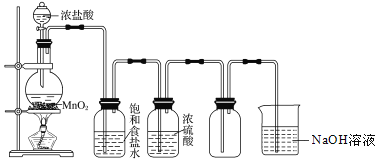
(1)气体发生装置中进行的反应化学方程式是______。
(2)在装置中:①饱和食盐水的作用是______,②浓硫酸的作用是______。
(3)化学实验中检验是否有![]() 产生常用湿润的淀粉
产生常用湿润的淀粉![]() 试纸
试纸![]() 如果有
如果有![]() 产生,可观察到的现象是______。
产生,可观察到的现象是______。
(4)写出尾气吸收装置中进行的反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组欲探究反应2Fe2+ + I2![]() 2Fe3+ + 2I,完成如下实验:
2Fe3+ + 2I,完成如下实验:
资料:AgI是黄色固体,不溶于稀硝酸。新制的AgI见光会少量分解。

(1)Ⅰ、Ⅱ均未检出Fe3+,检验Ⅱ中有无Fe3+的实验操作及现象是:取少量Ⅱ中溶液,______。
(2)Ⅲ中的黄色浑浊是______。
(3)经检验,Ⅱ→Ⅲ的过程中产生了Fe3+。
①对Fe3+产生的原因做出如下假设:
假设a:空气中存在O2,由于______(用离子方程式表示),可产生Fe3+;
假设b:溶液中Ag+具有氧化性,可产生Fe3+;
假设c: ______;
假设d:该条件下,I2溶液可将Fe2+氧化为Fe3+。
②通过实验进一步证实a、b、c不是产生Fe3+的主要原因,假设d成立。Ⅱ→Ⅲ的过程中I2溶液氧化Fe2+的原因是______。
(4)经检验,Ⅳ中灰黑色浑浊中含有AgI和Ag。
①验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,______。
② 为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验1和实验2。
实验1:向1 mL 0.1 mol·L1 FeSO4溶液中加入1 mL0.1 mol·L1 AgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如下图。

实验2:实验开始时,先向试管中加入几滴Fe2(SO4)3溶液,重复实验1,实验结果与实验1相同。
ⅰ.实验1中发生反应的离子方程式是______。
ⅱ.Ⅳ中迅速出现灰黑色浑浊的可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增大,且均不大于20。Y元素原子的最外层电子 数是内层电子数的3倍,Z元素原子的最外层电子数是最内层电子数的一半。甲是W、X两种元素形成的简单化合物,水溶液呈碱性,乙是Y元素的单质。在工业生产中它们有如下转化关系。下列叙述正确的是

A. 原子半径的大小W<X<Y<Z
B. 戊与丁反应过程中氧化剂与还原剂的物质的量之比为1:2
C. Y与Z形成的所有化合物中只存在离子键
D. X元素的氧化物对应的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素与我们的生活息息相关。回答下列问题:
(1)硝普钠(Na2[Fe(CN)5(NO)] 2H2O)可用于治疗急性心率衰竭。
①Fe3+的价电子轨道表示式为____________。
②硝普钠中不存在的作用力有____________(填序号)。
a.离子键 b.金属键 c.配位键 d.极性共价键 e.非极性共价键 f.氢键
③硝普钠的内界[Fe(CN)5(NO)]2-中,非金属元素的第一电离能由大到小的顺序为______,由其中两种元素按原子个数比为1:3组成的常见阴离子的空间构型为_________。
(2)三氯化铁是一种重要的铁盐,熔沸点较低,易溶于丙酮。
①FeCl3晶体类型为____________。
②FeCl3的熔点(555K)高于AlCl3(467K)的原因是_______________。
③Fe3+可用KSCN溶液检验,SCN-中σ键和π键的个数比为_______。
(3)某FexNy的晶胞如下图1所示,其化学式为____________,Cu可完全替代该晶体中的A位置Fe或B位置Fe,形成产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如下图2所示。其中更稳定的Cu替代型产物晶体的密度为ρ gcm-3,阿伏加德罗常数为NA,求晶胞参数a=___nm。
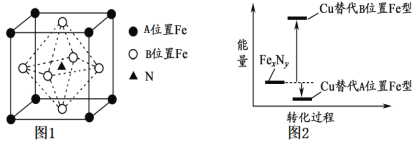
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,1 mol A和1 mol B在一个容积可变的密闭容器中发生如下反应:A(g)+2B(g)![]() 2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
A. 物质A、B的转化率之比一定是1:2
B. 起始时刻和达到平衡后容器中的压强比为1:1
C. 若起始放入3 mol A和3 mol B,则达到平衡时生成3a mol C
D. 当v(正)(A)=v(逆)(B)时,可断定反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ |
请按要求回答下列问题。
(1)元素④的名称是______,元素④在周期表中所处位置___________,从元素原子得失电子的角度看,元素④具有____________(填“氧化性”或“还原性”)。
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:_____________________(写氢化物的化学式)。
(3)元素⑦的原子结构示意图是____________。
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式________________,这一反应是___________(填“吸热”或“放热”)反应。
(5)用电子式表示①与⑨反应得到的化合物的形成过程_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2 ,有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2 ,有关该电池的说法正确的是
A. 放电时电解质溶液中的OH-向正极移动
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性增强
D. 充电时阳极反应:Ni(OH)2-e- + OH- = NiOOH + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com