
【题目】根据下表中部分短周期元素的原子半径及主要化合价信息:
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.152 | 0.143 | 0.160 | 0.102 | 0.074 |
主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
请判断以下叙述正确的是( )
A. 氢化物的沸点为H2T<H2R
B. L+与T2-的核外电子数相等
C. 单质L在空气中燃烧生成的氧化物中,氧元素化合价为-1价
D. M与T形成的二元化合物具有两性
【答案】D
【解析】
短周期元素,由元素的化合价可知,R和T都有-2价,位于元素周期表的第ⅥA族,T只有-2价,则T为O元素,可知R为S元素,L、M、Q的化合价分别为+1、+3、+2,则分别处于ⅠA族、ⅢA族、ⅡA族,原子半径Q>M>L,且半径大于S元素,则Q为Mg元素,M为Al元素,原子半径L的介于M、Q之间,则L为Li元素,据此答题。
由分析可知:L为Li元素,M为Al元素,Q为Mg元素,T为O元素,R为S元素。
A. T为O元素、R为S元素,H2R为H2S,H2T为H2O,水和硫化氢都为分子晶体,但是水分子中有氢键,所以沸点很高,即H2R<H2T,故A错误;
B. L为Li元素、T为O元素,L+的核外电子数为2,T2-的核外电子数为8,核外电子数不相等,故B错误;
C.L为Li元素,锂在空气中燃烧生成氧化锂,反应方程式为:4Li+O2![]() 2Li2O,氧化锂中氧元素化合价为-2价,故C错误;
2Li2O,氧化锂中氧元素化合价为-2价,故C错误;
D. M为Al元素、T为O元素,Al与O形成的化合物是氧化铝,是两性氧化物,具有两性,故D正确。
故选D。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】按要求用正确的化学用语回答下列问题:
(1)若116号元素用R表示其元素符号,则其最高价氧化物的化学式__________;
(2)写出含有8个质子、10个中子的原子化学符号_____________;
(3)用电子式表示Na2S的形成过程:_______________________________________;
(4)相同物质的量的D2O和H2O中,中子数之比是 ______________ ;
(5)如果氯化钠是由23Na及37Cl两种原子组成,则0.5mol氯化钠中含有的中子数为_______个。
(6)因为红磷比白磷稳定,所以燃烧相同质量的红磷和白磷,___________(填“白磷”或“红磷”)放出的热量多。
(7)除杂:除去乙烷中乙烯所涉及的化学方程式为________________________________ ;
(8)写出制备硝基苯的化学方程式____________________________________________ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗HIV、抗肿瘤、抗真菌和延缓心血管老化的活性苯并呋喃衍生物(R)的合成路线如下:
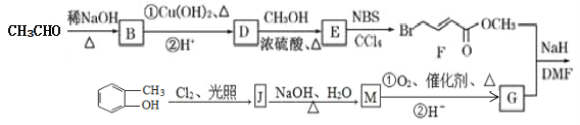

已知: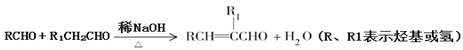
(1)苯并呋喃衍生物(R)的分子式为__________,含有的含氧官能团有________。
(2)E的结构简式为_________________,其核磁共振氢谱峰面积之比为________________。
(3)M→G中反应①的化学方程式为__________________,反应类型是________________。
(4)F与足量氢氧化钠溶液共热反应的化学方程式为_____________________。
(5)化合物G含有苯环的同分异构体有________种,其中苯环上只有一个侧链且能发生银镜反应的结构简式为____________________。
(6)参照上述合成路线,设计以甲苯和乙醛为原料制备苯丙烯酸(![]() )的合成路线____________。
)的合成路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品
(1)已知:25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
化学式 | HNO2 | H2N2O2 |
电离常数 | Ka=5.1×104 | Ka1=6.17×108 、Ka2=2.88×1012 |
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaNO2)_________pH(NaHN2O2)(填“>”“<”或“=”)。
②25℃时,NaHN2O2溶液中存在水解平衡,其水解常数Kh=____(保留三位有效数字)。
③0.1mol/L NaHN2O2溶液中离子浓度由大到小为:________________________________
(2)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
反应III:H2O(l)![]() H2O(g) ΔH3=+44.0 kJ·mol1。
H2O(g) ΔH3=+44.0 kJ·mol1。
则反应IV:NH3与CO2合成尿素同时生成液态水的热化学方程式为__________________。
(3)T1℃时,向容积为2 L的恒容密闭容器中充入n(NH3)∶n(CO2)=2∶1的原料气,使之发生反应IV,反应结束后得到尿素的质量为30 g,容器内的压强(p)随时间(t)的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为______________。
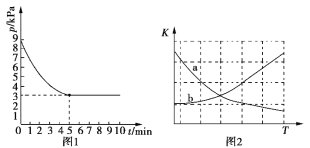
②图2中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米金(79Au)粒子在遗传免疫等方面有重大的应用前景,下列说法错误的是
A.Au为第六周期元素B.Au为黑色金属
C.Au的质子数为79D.纳米金表面积大吸附能力强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于图中装置说法正确的是

A. 装置中电流移动的途径:正极→Fe→M溶液→石墨→正极
B. 若M为滴加酚酞的NaCl溶液,通电一段时间后,铁电极附近溶液显红色
C. 若M为CuSO4溶液,可以实现石墨上镀铜
D. 若将电源反接,M为NaCl溶液,可以用于制备Fe(OH)2并可以使其较长时间保持白色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中H2O2的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1ml,滴定过程中发生的一个反应为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O。
②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为_________________。
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用_________。
a.普通漏斗和滤纸 b.布氏漏斗和滤纸 c.不需滤纸的微孔玻璃漏斗
(3)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因_____而导致KMnO4标准液的标定浓度偏高,在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是__________________。
(4)KMnO4标准液滴定H2O2的离子方程式为___________________;当滴定到______________可以认为已达到滴定终点。
(5)该医用消毒剂中H2O2的物质的量浓度为_______________mol·L-1。
(6)②中若用盐酸代替H2SO4,测定结果将___________(填“偏高”“ 偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)某原子含有 6 个质子和 8 个中子,用核素符号表示该原子__________;(用元素符号表示)
(2)写电子式:HClO:____;NH4+:_____;写结构式:CCl4:_____;CS2:_____;
(3)画出钙原子的原子结构示意图:____;画出溴离子的离子结构示意图:____;
(4)用电子式表示氯化钠的形成过程:_________________________
(5)按要求排序:
下列离子半径由大到小的顺序是:S2- ;Al3+ ;Na+ ;F- ;______________
下列物质熔沸点由高到低的顺序是:H2O;Na2O;H2Se;I2 ;______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com